题目内容
17.一般情况下,铜粉不溶于稀硫酸,但添加某物质后,则可反应生成硫酸铜(必要时可以加热).加入下列物质时,肯定不能促使铜粉溶解的是( )| A. | H2O2 | B. | FeCl3 | C. | O2 | D. | FeCl2 |
分析 铜粉不溶于稀硫酸,但添加某种物质后则可反应生成硫酸铜,则添加的物质具有强氧化性,据此解答.
解答 解:A.酸性环境下双氧水能够氧化铜,生成铜离子,故A不选;
B.三氯化铁具有强的氧化性能够与铜反应生成氯化亚铁和氯化铜,故B不选;
C.氧气在酸性环境下能够氧化铜生成氧化铜,氧化铜与酸反应生成铜盐,故C不选;
D.氯化亚铁不能氧化铜,不发生反应故D选.
故选:D.
点评 本题考查了元素及其化合物的性质,熟悉物质的氧化性是解题关键,题目难度不大.

练习册系列答案
相关题目
5.下面说法中正确的是( )
| A. | 标有“ ”的包装材料可以用来包装食品 ”的包装材料可以用来包装食品 | |
| B. | 酒精消毒原理是将病毒彻底氧化 | |
| C. | GaN中的氮和镓均属于第IIIA族元素 | |
| D. | 麦芽糖的水解产物能发生银镜反应 |
12.硫代硫酸钠是一种常见的化工原料,将SO2通入按一定比例配成的Na2S和Na2CO3的混合溶液中,便可得到Na2S2O3,其制备反应方程式为:2NaS+Na2CO3+4SO2═3Na2S2O3+CO2
(1)在配制混合溶液前先将蒸馏水加热煮沸一段时间后待用,其目的是赶走水中的溶解氧(或空气).
(2)用该方法获得的Na2S2O3.5H2O晶体中常混有一定量的杂质,某兴趣小组欲对其中所含杂质成分进行探究.
【提出假设】
该晶体中含有的杂质可能是:Na2CO3、Na2SO3、S、Na2S等中的一种或几种,若晶体中混有Na2SO3,则生成Na2SO3的化学方程式为SO2+Na2CO3═Na2SO3+CO2
【判断与思考】
某同学取少量制得的晶体溶于足量稀硫酸,并将产生的气体通入CuSO4溶液中,未见黑色沉淀,据此认为晶体中一定不含Na2S,你认为其结论是否合理?不合理 (填“合理”、“不合理”)并说明理由:Na2S2O3与稀H2SO4反应生成的SO2和硫化钠与硫酸反应的H2S发生反应生成硫单质,可能无H2S逸出
【设计方案进行实验】
若检验晶体中含Na2CO3,完成下表实验方案、现象及结论(仪器自选).
限选实验试剂:3mol•L-1H2SO4、1mol•L-1NaOH酸性KMnO4溶液、饱和NaHCO3溶液、品红溶液、澄清石灰水
(3)已知:2Na2S2O3+I2═2NaI+Na2S4O6..为测定所制得晶体的纯度,该小组以淀粉作指示剂,用0.010mol•L-1的碘水进行多次取样滴定,测得Na2S2O3•5H2O的含量约为102%.若所用试剂及操作均无不当,产生该结果最可能的原因是晶体中含有杂质(如Na2S等)在滴定时参与反应或晶体部分失去结晶水.
(1)在配制混合溶液前先将蒸馏水加热煮沸一段时间后待用,其目的是赶走水中的溶解氧(或空气).
(2)用该方法获得的Na2S2O3.5H2O晶体中常混有一定量的杂质,某兴趣小组欲对其中所含杂质成分进行探究.
【提出假设】
该晶体中含有的杂质可能是:Na2CO3、Na2SO3、S、Na2S等中的一种或几种,若晶体中混有Na2SO3,则生成Na2SO3的化学方程式为SO2+Na2CO3═Na2SO3+CO2
【判断与思考】
某同学取少量制得的晶体溶于足量稀硫酸,并将产生的气体通入CuSO4溶液中,未见黑色沉淀,据此认为晶体中一定不含Na2S,你认为其结论是否合理?不合理 (填“合理”、“不合理”)并说明理由:Na2S2O3与稀H2SO4反应生成的SO2和硫化钠与硫酸反应的H2S发生反应生成硫单质,可能无H2S逸出
【设计方案进行实验】
若检验晶体中含Na2CO3,完成下表实验方案、现象及结论(仪器自选).
限选实验试剂:3mol•L-1H2SO4、1mol•L-1NaOH酸性KMnO4溶液、饱和NaHCO3溶液、品红溶液、澄清石灰水
| 实验方案 | 现象及结论 |
2.下列归类中,正确的是( )
| A. | Fe、Si--主族元素 | B. | Na2O2--碱性氧化物 | ||
| C. | 阿司匹林--抗酸药 | D. | 醋--调味剂和防腐剂 |
9.下列有关说法正确的是( )
| A. | 已知:HI(g)═12H2(g)+12I2(s)△H=-26.5kJ/mol,由此可知1mol HI气体在密闭容器中充分分解后可以放出26.5kJ的热量 | |
| B. | 已知:2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol,则氢气的燃烧热为△H=-285.8kJ/mol | |
| C. | 肼(N2H4)是一种用于火箭或燃料电池的原料,已知2H2O(g)+O2(g)=2H2O2(l)△H=+108.3kJ/mol ①N2H4(l)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ/mol ②则有反应:N2H4(l)+2H2O2(l)=N2(g)+4H2O(l)△H=-642.3kJ/mol | |
| D. | 含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l)△H=-57.4kJ/mol |
6.下列化学用语书写正确的是( )
| A. | 纯碱溶液呈碱性的原因是:CO32-+2H2O?H2CO3+2OH- | |
| B. | 电解MgCl2水溶液的离子方程式:2Cl-+2 H2O 通电_H2↑+Cl2↑+2OH- | |
| C. | 质量数之和是质子数之和两倍的水分子符号可能是:D216O | |
| D. | 固体酒精是餐桌上常用的燃料,已知酒精的标准燃烧热是-1366.8kJ•mol-1,则表示酒精标准燃烧热的热化学方式式为: C2H5OH(s)+3O2(g)=2CO2(g)+2 H2O(l)△H=-1366.8kJ•mol-1 |
7.下列说法或表达正确的是( )
| A. | 石油是混合物,其分馏产品汽油也是混合物 | |
| B. | NH4I的电子式: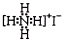 | |
| C. | 糖类、蛋白质和乙酸都是人体必需的营养物质 | |
| D. | 陶瓷、水晶、水泥、玻璃都属于硅酸盐 |
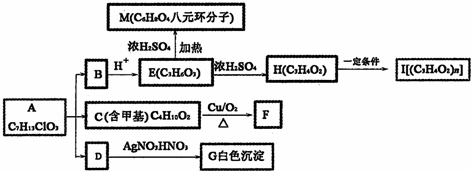
 +O2
+O2 +2H2O;②E→M:2HOCH2CH2COOH
+2H2O;②E→M:2HOCH2CH2COOH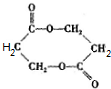 +2H2O;
+2H2O;