题目内容
16.(1)微粒${\;}_{11}^{23}$Na+中质子数是11,中子数是12,核外电子数是10.(2)下列3种不同粒子 ${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H表示1种元素,3种核素,${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H互称为同位素,它们的化学性质相同.(填“相似”或“不同”)
(3)${\;}_{11}^{24}$Mg表示Mg原子核外电子所占据的电子层中,能量最高的是M层(填符号).
分析 (1)在阳离子中,质量数=质子数+中子数;核电荷数=质子数=核外电子数+所带电荷数;
(2)根据元素的种类由质子数决定分析,根据质子数、中子数和核数、同位素的概念判断,同位素最外层电子数相同;
(3)距离原子核越远,能层能量越高能量越高,Mg原子核外电子排到M层.
解答 解:(1)因2311Na+的质子数为11,质量数为23,中子数=质量数-质子数=23-11=12,核外电子数=质子数-所带电荷数=11-1=10,故答案为:11;12;10;
(2)元素就是具有相同的核电荷数(即核内质子数)的一类原子的总称,不同种元素最本质的区别是质子数不同,元素的种类由质子数决定,11H、12H、13H的质子数都是1,所以3种不同粒子${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H表示同一种元素氢元素;
核素是指具有一定数目质子和一定数目中子的一种原子;11H、12H、13H的质子数都是1,中子数分别为0、1、2,属于三种核数;
具有相同质子数,不同中子数同一元素的不同核素互为同位素;11H、12H、13H的质子数都是1,中子数分别为0、1、2,属于同位素;
同位素最外层电子数相同,化学性质相同,故答案为:1;3;同位素;相同;
(3)2412Mg的电子数为12,核外电子排布为1s22s22p63s2,距离原子核越远,能层能量越高,因此能量最高的为M层,故答案为:M.
点评 本题考查原子的表示式、核素、同位素、质量数A=质子数Z+中子数N的计算和核外电子排布规律,解答此类题,除了解核组成符号外,还要记住两个关系:A═Z+N,质子数═核外电子数═原子序数═质量数-中子数.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
6.有关化学用语正确的是( )
| A. | 乙烯的最简式C2H4 | B. | 丙酮的分子式C3H6O | ||
| C. | 四氯化碳的电子式为: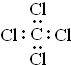 | D. | 乙醇的结构简式C2H6O |
7.下列过程不能同时生成两种盐的是( )
| A. | FeCl3溶液溶解铜 | B. | NaOH溶液吸收Cl2 | C. | Fe3O4与盐酸反应 | D. | CuCl2与Zn反应 |
1.可逆反应A+3B?2C+2D(各物质均为气体)在不同条件下测得的下列4种反应速率,其中反应最快的是( )
| A. | υD=0.4mol/(L•s) | B. | υC=0.5mol/(L•s) | C. | υB=0.6mol/(L•s) | D. | υA=0.22mol/(L•s) |