题目内容
13.现有0.3mol的BaSO4沉淀.每次用1L饱和Na2CO3溶液(浓度为1.7mol•L-1)处理,若使BaSO4中的SO42-全部转化到溶液中,需要反复处理5次.[提示:BaSO4(s)+CO32-(aq)?BaCO3(s)+SO42-(aq);ksp(BaSO4)=1.07×10-10、Ksp(BaCO3)=2.58×10-9].分析 转化的方程式为BaSO4 +CO32-=BaCO3 +SO42-,K=c(SO42−)c(CO32−)=1.07×10−102.58×10−9=0.042,结合方程式计算.
解答 解;设每次用1L1.7 mol•L-1饱和Na2CO3溶液能处理xmol BaSO4,
BaSO4 +CO32-=BaCO3 +SO42-
(1.7-x)mol•L-1 x mol•L-1
根据K=c(SO42−)c(CO32−)=x1.7−x=1.07×10−102.58×10−9=0.042,
解得:x=0.066,处理次数=0.3mol0.066mol=4.5,所以至少处理5次.
故答案为:5.
点评 本题考查了难溶电解质的溶解平衡及弱电解质的电离,为高频考点,侧重于学生的分析、计算能力的考查,结合溶度积常数来分析解答,难度中等.

练习册系列答案
 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
8.在同温同压下,某有机物和过量Na反应得到V1 L氢气,另一份等量的该有机物和足量的NaHCO3反应得到V2 L二氧化碳,若V1=V2≠0,则该有机物可能是( )
| A. |  | B. | HOOC-COOH | C. | HOCH2CH2OH | D. | CH3COOH |
2.准确取20.00mL某待测HCl溶液于锥形瓶中,用0.1000mol•L-1NaOH溶液滴定,下列说法正确的是( )
| A. | 滴定管用蒸馏水洗涤后,装入NaOH溶液进行滴定 | |
| B. | 随着NaOH溶液滴入,锥形瓶中溶液pH由小变大 | |
| C. | 用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定 | |
| D. | 滴定终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小 |
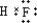 .
.