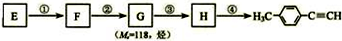
题目内容
关于下列电解质溶液的说法中,正确的是( )
| A、常温下,10mL 0.2mol/L NH4NO3溶液与10mL 0.1mol/L NaOH溶液混合后所得pH=9.6的溶液中:c(NO3-)>c(NH4+)>c(Na+)>c(NH3?H2O)>c(OH-)>c(H+) |
| B、0.1mol/L Na2S溶液中:c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-) |
| C、常温下a mL 0.1mol/L KOH与b mL 0.1mol/L HCN两溶液混合后pH>7,则一定有a≥b |
| D、10mL 0.1mol/L NaCl溶液中离子总数为x,10mL 0.1mol/L CH3COONa溶液中离子总数为y,则x=y |
考点:离子浓度大小的比较
专题:电离平衡与溶液的pH专题,盐类的水解专题
分析:A.混合溶液中溶质为等物质的量浓度的NH4NO3、NaNO3、NH3.H2O,溶液呈碱性,说明一水合氨电离程度大于铵根离子水解程度;
B.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
C.HCN的酸性很弱,如果溶液中有很少量HCN和大量NaCN,溶液可能也呈碱性;
D.根据电荷守恒判断.
B.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
C.HCN的酸性很弱,如果溶液中有很少量HCN和大量NaCN,溶液可能也呈碱性;
D.根据电荷守恒判断.
解答:
解:A.根据物料守恒c(NH4+)+c(NH3?H2O)=c(NO3-)=2c(Na+),电荷守恒c(Na+)+c(NH4+)+c(H+)=c(NO3-)+c(OH-),又知c(OH-)>c(H+),所以c(NH4+)>c(Na+)>c(NH3?H2O),故A正确;
B.0.1 mol/LNa2S溶液中:c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-),故B错误;
C.HCN是弱酸,如果a=b则溶液pH>7,如果a<b则有可能溶液pH>7,所以溶液pH>7不一定a≥b,a<b也有可能,故C错误;
D.NaCl溶液中电荷守恒:c(Na+)+c(H+)=c(Cl-)+c(OH-),则溶液中的离子总数为2[c(Na+)+c(H+)]V,CH3COONa溶液中电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),则溶液中的离子总数为2[c(Na+)+c(H+)]V,又因CH3COONa溶液显碱性,c(OH-)>c(H+),NaCl溶液呈中性,c(OH-)=c(H+),所以NaCl溶液中的c(H+)大于CH3COONa溶液中的c(H+),所以NaCl溶液中离子总数大于CH3COONa溶液中离子总数,故D错误;
故选A.
B.0.1 mol/LNa2S溶液中:c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-),故B错误;
C.HCN是弱酸,如果a=b则溶液pH>7,如果a<b则有可能溶液pH>7,所以溶液pH>7不一定a≥b,a<b也有可能,故C错误;
D.NaCl溶液中电荷守恒:c(Na+)+c(H+)=c(Cl-)+c(OH-),则溶液中的离子总数为2[c(Na+)+c(H+)]V,CH3COONa溶液中电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),则溶液中的离子总数为2[c(Na+)+c(H+)]V,又因CH3COONa溶液显碱性,c(OH-)>c(H+),NaCl溶液呈中性,c(OH-)=c(H+),所以NaCl溶液中的c(H+)大于CH3COONa溶液中的c(H+),所以NaCl溶液中离子总数大于CH3COONa溶液中离子总数,故D错误;
故选A.
点评:本题考查离子浓度大小比较,正确判断溶液中溶质的性质是解本题关键,再结合守恒思想分析解答,注意D选项中根据电荷守恒和酸根离子水解综合解答,为易错点.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
常温下,将a mL b mol/L CH3COOH溶液加入到c mL d mol/L NaOH溶液中.下列结论中,不正确的是( )
| A、如果ab=cd,则反应后溶液的pH>7 |
| B、如果a=c,且反应后溶液的pH<7,则b<d |
| C、如果a=c、b=d,则反应后的溶液中c(CH3COO-)<c(Na+) |
| D、如果反应后溶液的pH=7,则此溶液中c(CH3COO-)=c(Na+) |
某烯烃的结构简式为:

其命名正确的是( )

其命名正确的是( )
| A、2-甲基-5-乙基-3,5己二烯 |
| B、2-乙基-1,3-己二烯 |
| C、6-甲基-3,4-庚二烯 |
| D、5-甲基-2-乙基-1,3-己二烯 |
下列说法中,正确的是( )
| A、相邻的原子之间的相互作用叫做化学键 |
| B、金属和非金属元素的相互化合,都能形成离子键 |
| C、非金属元素的原子半径比其离子半径小(氢除外),金属元素的原子的原子半径比其离子半径大 |
| D、甲元素原子半径比乙元素原子半径大,则甲的离子半径一定比乙的原子半径大 |
某软质隐形眼镜材料为如图所示的聚合物.下列有关说法错误的是( )
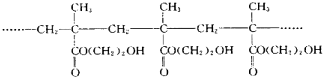

| A、生成该聚合物的反应属于加聚反应 |
| B、该聚合物的单体是丙酸乙酯 |
| C、该聚合物分子中存在大量的-OH,所以具有较好的亲水性 |
D、该聚合物的结构筒式为: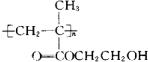 |
航天飞船可用肼(N2H4)作动力源.已知1g液态肼和足量的液态过氧化氢反应生成N2和水蒸气时放出20.05kJ热量,化学方程式如下:N2H4+2H2O2═N2↑+4H2O.下列说法中错误的是( )
| A、该反应中肼作还原剂 |
| B、此情况下,液态肼燃烧生成1molN2时放出的热量为641.6kJ |
| C、肼(N2H4)分子中只存在极性共价键 |
| D、该反应的反应物总能量高于生成物的总能量 |
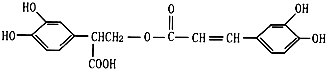
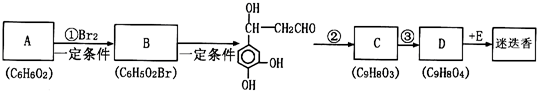
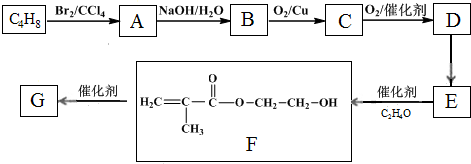
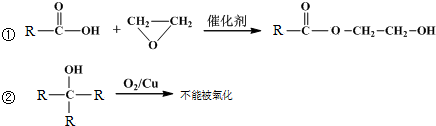
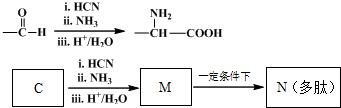
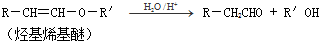
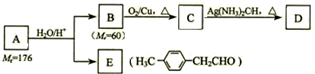
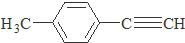 )的一条路线如下:
)的一条路线如下: