题目内容
航天飞船可用肼(N2H4)作动力源.已知1g液态肼和足量的液态过氧化氢反应生成N2和水蒸气时放出20.05kJ热量,化学方程式如下:N2H4+2H2O2═N2↑+4H2O.下列说法中错误的是( )
| A、该反应中肼作还原剂 |
| B、此情况下,液态肼燃烧生成1molN2时放出的热量为641.6kJ |
| C、肼(N2H4)分子中只存在极性共价键 |
| D、该反应的反应物总能量高于生成物的总能量 |
考点:反应热和焓变,极性键和非极性键
专题:化学反应中的能量变化,化学键与晶体结构
分析:A、根据反应中肼的分子中化合价的变化分析;
B、根据燃烧热的定义和1g液态肼燃烧放出的热量计算;
C、从肼的分子结构分析;
D、反应放热说明反应物能量高.
B、根据燃烧热的定义和1g液态肼燃烧放出的热量计算;
C、从肼的分子结构分析;
D、反应放热说明反应物能量高.
解答:
解:A、N2H4中N元素为-2价,反应后生成N2为0价,所以N元素化合价升高,所以肼作还原剂,故A正确;
B、1g液态肼和足量液态过氧化氢反应生成氮气和水蒸气时放出20.05kJ的热量,则1mol肼反应放出的热量为32×20.05=641.60(kJ),故B正确;
C、肼中存在N-H键也有N-N键,结构简式为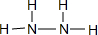 ,故C错误;
,故C错误;
D、反应放热,所以反应物的总能量高于生成物的总能量,故D正确.
故选:C.
B、1g液态肼和足量液态过氧化氢反应生成氮气和水蒸气时放出20.05kJ的热量,则1mol肼反应放出的热量为32×20.05=641.60(kJ),故B正确;
C、肼中存在N-H键也有N-N键,结构简式为
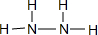 ,故C错误;
,故C错误;D、反应放热,所以反应物的总能量高于生成物的总能量,故D正确.
故选:C.
点评:本题将热化学方程式的知识、氧化还原、化学键、放热反应等基础知识结合起来,综合性较强.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
关于下列电解质溶液的说法中,正确的是( )
| A、常温下,10mL 0.2mol/L NH4NO3溶液与10mL 0.1mol/L NaOH溶液混合后所得pH=9.6的溶液中:c(NO3-)>c(NH4+)>c(Na+)>c(NH3?H2O)>c(OH-)>c(H+) |
| B、0.1mol/L Na2S溶液中:c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-) |
| C、常温下a mL 0.1mol/L KOH与b mL 0.1mol/L HCN两溶液混合后pH>7,则一定有a≥b |
| D、10mL 0.1mol/L NaCl溶液中离子总数为x,10mL 0.1mol/L CH3COONa溶液中离子总数为y,则x=y |
金属M和N可构成如图所示的装置.下列分析正确的是( )
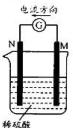

| A、金属活性性N>M |
| B、M逐渐溶解 |
| C、负极反应为2H++2e-═H2↑ |
| D、SO42-向M极定向移动 |
下列关于有机化合物的认识正确的是( )
| A、天然油脂是高分子化合物,同时也是混合物 |
| B、淀粉、纤维素的分子式都是(C6H10O5)n,二者互为同分异构体 |
| C、氨基酸和蛋白质分子中都含有氨基和羧基,二者均有两性 |
| D、糖类、油脂、蛋白质均能发生水解 |
能正确表示下列反应的离子方程式是( )
| A、钠与水反应:Na+2H2O═Na++OH-+H2↑ | ||||
| B、KI溶液中滴入稀硫酸,空气中振荡:4H++4I-+O2═2I2+2H2O | ||||
| C、CuCl2溶液中加入氨水Cu2++2OH-═Cu(OH)2↓ | ||||
D、向NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-
|
用NA表示阿伏加德罗常数,下列说法正确的是( )
| A、0.1mol的D37Cl分子中的中子数是2NA |
| B、46g乙醇所含的羟基的电子数是7NA |
| C、2.3g Na与足量O2反应,生成Na2O和Na2O2的混合物,钠共失去0.1NA个电子 |
| D、18g葡萄糖分子中含有共用电子对数为2.2NA |
下列关于煤的叙述中不正确的是( )
| A、煤是工业上获得芳香烃的一种重要来源 |
| B、煤的干馏过程属于化学变化 |
| C、煤是由多种有机物组成的混合物 |
| D、煤除了主要含有碳元素外,还含有少量的氢、氮、硫、氧等元素 |
