题目内容
5.金属加工后的废切削液中含2-5%的NaNO2,它是一种环境污染物.人们用NH4Cl溶液来处理此废切削液,使NaNO2转化为无毒物质.该反应分两步进行:第一步:NaNO2+NH4Cl=NaCl+NH4NO2,
第二步:NH4NO2=N2↑+2H2O
下列对第二步反应的叙述中正确的是( )
①NH4NO2只作氧化剂 ②NH4NO2是氧化产物也是还原产物
③氧化产物和还原产物的质量之比是1:1 ④只有氮元素的化合价发生了变化 ⑤NH4NO2既是氧化剂又是还原剂.
| A. | ①③ | B. | ①④ | C. | ②③④ | D. | ③④⑤ |
分析 该反应中N元素的化合价由-3价变为0价,由+3价变为0价,得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂,结合分解反应的概念降低.
解答 解:NH4NO2中N元素的化合价由-3价变为0价,由+3价变为0价,该反应中只有N元素的化合价发生变化,所则NH4NO2既是氧化剂又是还原剂,并且生成的氧化产物和还原产物都是氮气,质量之比是1:1,则③④⑤正确,故选D.
点评 本题考查氧化还原反应,明确元素化合价是解本题关键,知道基本概念.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
15.在①丙烯②氯乙烯③苯④甲苯四种有机化合物中,分子内所有原子均在同一平面的是( )
| A. | ②③ | B. | ②④ | C. | ①③ | D. | ③④ |
16.足量的氯气和盐酸分别与等质量的铁反应,铁原子失去的电子数目前者与后者的关系是( )
| A. | 大于 | B. | 小于 | C. | 等于 | D. | 不能确定 |
20.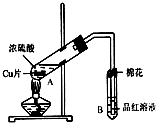 某研究小组用如图所示装置进行铜与浓硫酸反应的实验研究.
某研究小组用如图所示装置进行铜与浓硫酸反应的实验研究.
(1)写出试管B中的实验现象品红溶液褪色.
(2)写出A中反应的化学方程式Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O
(3)B试管口的棉花应沾有的试剂是NaOH.
(4)反应后有铜剩余,若不补充浓硫酸,要使铜片溶解,继续向A试管中加入H2O2,发现铜片又溶解,反应的离子方程式为:Cu+H2O2+2H+=Cu2++2H2O.或者可以加Fe2O3、NaNO3(填写两种属于不同类别物质的化学式),也能使铜片溶解.
(5)小组成员向反应后的溶液中加入足量的氧化铜,使剩余的硫酸全部转化为硫酸铜,过滤后,将滤液加热浓缩,冷却结晶制得硫酸铜晶体(CuSO4•xH2O).小组成员采用加热法测定该晶体里结晶水x的值.
下面是其中一次实验的数据:
根据上表数据计算判断x的实侧值比理论值(x=5)偏小(填“偏大”、“偏小”),这次实验中产生误差的原因可能是AD(填序号)
A.硫酸铜晶体中含有不挥发的杂质 B.实验前晶体表面有湿存水
C.加热时有晶体飞溅出去 D.加热失水后露置在空气中冷却.
 某研究小组用如图所示装置进行铜与浓硫酸反应的实验研究.
某研究小组用如图所示装置进行铜与浓硫酸反应的实验研究.(1)写出试管B中的实验现象品红溶液褪色.
(2)写出A中反应的化学方程式Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O
(3)B试管口的棉花应沾有的试剂是NaOH.
(4)反应后有铜剩余,若不补充浓硫酸,要使铜片溶解,继续向A试管中加入H2O2,发现铜片又溶解,反应的离子方程式为:Cu+H2O2+2H+=Cu2++2H2O.或者可以加Fe2O3、NaNO3(填写两种属于不同类别物质的化学式),也能使铜片溶解.
(5)小组成员向反应后的溶液中加入足量的氧化铜,使剩余的硫酸全部转化为硫酸铜,过滤后,将滤液加热浓缩,冷却结晶制得硫酸铜晶体(CuSO4•xH2O).小组成员采用加热法测定该晶体里结晶水x的值.
下面是其中一次实验的数据:
| 坩埚质量 | 坩埚与晶体的总质量 | 加热后坩埚与固体总质量 |
| 11.7g | 22.7g | 18.9g |
A.硫酸铜晶体中含有不挥发的杂质 B.实验前晶体表面有湿存水
C.加热时有晶体飞溅出去 D.加热失水后露置在空气中冷却.
10.下列实验设计科学合理的是( )
| A. | 将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中 | |
| B. | 某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性 | |
| C. | 用Ba(NO3)2溶液鉴别Cl-、SO42-和CO32- | |
| D. | 用洁净铂丝蘸取溶液进行焰色反应,火焰呈黄色,可知原溶液中有Na+无K+ |
14.有机物分子中原子间(或原子与原子团间)的相互影响会导致物质化学性质的不同.下列各项的事实不能说明上述观点的是( )
| A. | 甲苯能使酸性高锰酸钾溶液褪色,而甲烷不能使酸性高锰酸钾溶液褪色 | |
| B. | 乙醛能与氢气加成,而乙酸不能与氢气加成 | |
| C. | 乙醇能与金属钠反应,而甲醚不能与金属钠反应 | |
| D. | 苯酚能与NaOH溶液反应,而乙醇不能与NaOH溶液反应 |
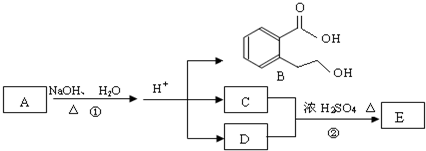
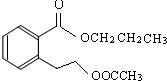 .
.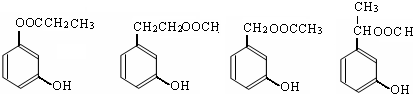 任意2个.
任意2个.