题目内容
6.(1)将质量比为14:15的N2和NO混合,则混合气体中N2和NO的物质的量之比为1:1,氮原子和氧原子的个数比为3:1.(2)5molCO2在标准状况下所占的体积约为112L;所含氧原子的数目约为6.02×1024.
(3)12.4g Na2X中含有0.4mol Na+,则Na2X的摩尔质量是62g/mol,该物质的化学式为Na2O.
(4)在125mL 0.2mol/L NaOH溶液中含1g溶质;配制50mL 0.2mol/L CuSO4溶液,需要CuSO4•5H2O2.5g.
分析 (1)根据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$结合分子构成计算;
(2)根据n=$\frac{V}{{V}_{m}}$=$\frac{N}{N}$结合分子构成计算;
(3)根据n=$\frac{m}{M}$计算;
(4)根据n=cV=$\frac{m}{M}$计算.
解答 解:(1)质量比为14:15的N2和NO混合,则混合气体中N2和NO的物质的量之比为$\frac{14}{28}$:$\frac{15}{30}$=1:1,氮原子和氧原子的个数比为(2×1+1):1=3:1,
故答案为:1:1; 3:1;
(2)V=5mol×22.4L/mol=112L,所含氧原子的数目约为5mol×2×6.02×1023=6.02×1024,
故答案为:112L;6.02×1024;
(3)n(Na2X)=$\frac{1}{2}$n(Na+)=0.2mol,M(Na2X)=$\frac{12.4g}{0.2mol}$=62g/mol,M(X)=62-46=16,则X为O元素,化学式为Na2O,
故答案为:62g/mol;Na2O;
(5)n(NaOH)=$\frac{1g}{40g/mol}$=0.025mol,V=$\frac{0.025mol}{0.2mol/L}$=0.125L=125mL,
n(CuSO4•5H2O)=n(CuSO4)=0.05L×0.2mol/L=0.01mol,m(CuSO4•5H2O)=0.01mol×250g/mol=2.5g,
故答案为:125; 2.5.
点评 本题考查物质的量的有关计算,题目难度较大,比较综合,注意物质的量与质量、体积、粒子数目、浓度的计算公式的运用.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用,锌锰碱性电池以氢氧化钾溶液为电解液,电池总反应为Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s),下列说法正确的是( )
| A. | 电池工作时,MnO2失去电子 | |
| B. | 电池工作时,电子由锌经外电路流向MnO2 | |
| C. | 从反应方程式来看,不使用氢氧化钾,也不影响电流大小 | |
| D. | 电池正极的电极反应式为:2MnO2(s)+H2O(l)+2e-═Mn2O3(s)+2OH-(aq) |
17.下列互为同位素的是( )
| A. | H2和D2 | B. | O2和O3 | C. | CO和CO2 | D. | 12C和13C |
14. 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( )
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( )
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( )
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( )| A. | 2.7gAl与足量的该硫酸反应可得到标准状况下的H2 3.36L | |
| B. | 该硫酸50 mL与足量的铜反应可得到标准状况下SO2 10.3 L | |
| C. | 配制200 mL 4.6 mol•L-1的稀硫酸需该硫酸50 mL | |
| D. | 该硫酸与等体积的水混合所得溶液的质量分数小于49% |
 由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液跟烧碱反应制得白色纯净的Fe(OH)2沉淀,应用如图所示装置可以制得白色纯净的Fe(OH)2沉淀.两极材料分别为铁和石墨.
由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液跟烧碱反应制得白色纯净的Fe(OH)2沉淀,应用如图所示装置可以制得白色纯净的Fe(OH)2沉淀.两极材料分别为铁和石墨.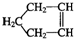 可简写为
可简写为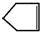 .降冰片烯的分子结构可表示为:
.降冰片烯的分子结构可表示为: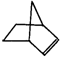
 .
.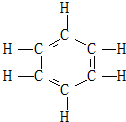 1866年凯库勒提出了苯的单、双键交替的正六边形平面结构(如图),解释了苯的部分性质,但还有一些问题尚未解决,如它不能解释( )
1866年凯库勒提出了苯的单、双键交替的正六边形平面结构(如图),解释了苯的部分性质,但还有一些问题尚未解决,如它不能解释( )