题目内容
【题目】根据以下反应:
KMnO4+ Na2SO3+ H2SO4= MnSO4+ Na2SO4+ K2SO4+ H2O
回答下列问题:
I.请配平该反应方程式___,该反应还原剂是___,还原产物是___。
II.当反应转移1mol电子时,被氧化的物质的质量为___g。
Ⅲ.用单线桥法标出反应中电子转移的方向和数目___。
【答案】2KMnO4+5Na2SO3+3H2SO4=2MnSO4+5Na2SO4+1K2SO4+3H2O Na2SO3 MnSO4 63 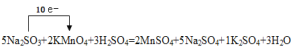
【解析】
I.KMnO4中锰元素化合价由+7降低为+2,KMnO4被还原为MnSO4,还原产物是MnSO4;Na2SO3中硫元素化合价由+4升高为+6,Na2SO3是还原剂;根据得失电子守恒、元素守恒,配平该反应方程式为2KMnO4+5Na2SO3+3H2SO4=2MnSO4+5Na2SO4+1K2SO4+3H2O。
II.Na2SO3中硫元素化合价由+4升高为+6,1mol Na2SO3被氧化,转移电子2mol,所以当反应转移1mol电子时,被氧化的Na2SO3物质的量为0.5mol,质量为0.5mol ×126g/mol=63g。
Ⅲ.用单线桥法标出反应中电子转移的方向和数目为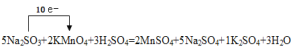 。
。

练习册系列答案
相关题目