��Ŀ����
����Ŀ��I�����г�����pH��2��HCl��Һ��pH��2��CH3COOH��Һ�ң���������в����ش����⣺
��1��������0.1mol��L��1��CH3COOH��Һ��ˮϡ�����У����б���ʽ������һ����С����_____��
A��c(H��) B��![]() C��c(H��)��c(OH��)
C��c(H��)��c(OH��)
��2��ȡ10mL������Һ������������ˮ��CH3COOH�ĵ���ƽ��________(��������ҡ�����)�ƶ�����ȡ10mL������Һ������������ˮ�����ƹ���(����������ǰ����Һ������ֲ���)���������ܽ����Һ��![]() �ı�ֵ��________(�������С������ȷ����)��
�ı�ֵ��________(�������С������ȷ����)��
��3��ȡ������ļס�������Һ���ֱ��õ�Ũ�ȵ�NaOHϡ��Һ�кͣ�������NaOH��Һ����Ĵ�С��ϵΪV(��)________(���������������)V(��)��
��4����֪25��ʱ��������ĵ���ƽ�ⳣ�����£�
��ѧʽ | CH3COOH | H2CO3 | HClO |
����ƽ�ⳣ�� | 1.8��10��5 | K1��4.3��10��7 K2��4.7��10��11 | 3.0��10��8 |
�����������ӽ��H��������ǿ����________��
A��HCO B��CO![]() C��ClO�� D��CH3COO��
C��ClO�� D��CH3COO��
д�����з�Ӧ�����ӷ���ʽ��HClO��Na2CO3(����)��______________________
II�������£�0.1 mol��L��l��KOH��Һ��10.00mL 0.10 mol��L��l H2C2O4 (��Ԫ���ᣩ��Һ�����õζ�������ͼ(�����Һ������ɿ��ɻ��ǰ��Һ�����֮��)����ش��������⣺
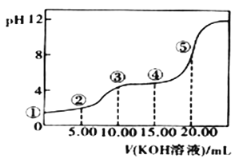
��5�������ʾ��Һ���������ӵ�Ũ���ɴ�С��˳��Ϊ��________________________�������ʾ��Һ�У�c(K+)+c(H2C2O4)+c(HC2O4)+c(C2O42)��________mol/L��
���𰸡� A ���� ��С �� B�� HClO��CO![]() ===ClO����HCO c(K+)>c(HC2O4�D)>c(H+)>c(C2O42-)>c(OH�D) 0.10
===ClO����HCO c(K+)>c(HC2O4�D)>c(H+)>c(C2O42-)>c(OH�D) 0.10
�������� (1)��ˮϡ�ʹٽ�����������������������̶�С����Һ�������̶���������Һ��c(H+)��c(CH3COOH)��c(CH3COO-)����С�����¶Ȳ�����ˮ�����ӻ�����������
(2)��ˮϡ�ʹٽ����������������м�����ͬ�������������ƴ��������
(3)pH��ͬ�Ĵ���Ũ�ȴ���������ȡ�������pH�Ĵ����������n(CH3COOH)>n(HCl)���ֱ��õ�Ũ�ȵ�NaOH��Һ�к���������ʵ���������ĵļ����
(4) ����ƽ�ⳣ��Խ������ĵ���̶�Խ������Һ����Խǿ�����ݱ������ݿ���֪����������ǿ������˳��Ϊ��CH3COOH > H2CO3> HClO > HCO3-������Խ������Ӧ��������ӽ�������ӵ�����Խǿ��
��5�������Һ������,�������Ũ�ȷ�Ӧ����KHC2O4�����������ˮ������ܸ��������غ���������
���:(1)A�������ڼ�ˮϡ��ʱ��c(H+)��c(CH3COOH)��c(CH3COO-)����С����A��ȷ��
B����![]() ���������ӡ���ĸͬ������Һ�е�c(CH3COO-)��
���������ӡ���ĸͬ������Һ�е�c(CH3COO-)��![]() �����ڼ�ˮϡ��ʱc(CH3COO-)��С����ֵ��������B������
�����ڼ�ˮϡ��ʱc(CH3COO-)��С����ֵ��������B������
C���¶Ȳ�����ˮ�����ӻ���������������c(H��)��c(OH��)��������C������
����Aѡ������ȷ����
(2)��ˮϡ�ʹٽ����������ƽ�������ƶ���������м�����ͬ�������������ƴ��������ƽ�������ƶ���������Һ��![]() �ı�ֵ����С��
�ı�ֵ����С��
��ˣ�������ȷ��������������С��
(3) pH��ͬ�Ĵ���Ũ�ȴ���������ȡ�������pH�Ĵ����������n(CH3COOH)>n(HCl)���ֱ��õ�Ũ�ȵ�NaOH��Һ�к���������ʵ���������ĵļ����������������������Һ�����<����
��ˣ�������ȷ������<��
(4) ����ƽ�ⳣ��Խ������Ӧ�����������ӵ�����ԽС������ݵ���ƽ�ⳣ������֪�����H+������ǿ����CO![]() ������Bѡ������ȷ����̼��Ķ�������С�ڴ�����������̼��������ӵ�����С�ڴ���������HClO������Na2CO3��Һ��Ӧ�����ӷ���ʽΪ��HClO��CO
������Bѡ������ȷ����̼��Ķ�������С�ڴ�����������̼��������ӵ�����С�ڴ���������HClO������Na2CO3��Һ��Ӧ�����ӷ���ʽΪ��HClO��CO![]() ===ClO����HCO ��
===ClO����HCO ��
��ˣ�������ȷ������B��HClO��CO![]() ===ClO����HCO ��
===ClO����HCO ��
(5) �����Һ���������������Ũ�ȷ�Ӧ����KHC2O4��HC2O4-���������ˮ������c(K+)>c(HC2O4�D)>c(H+)>c(C2O42-)>c(OH�D)��
��(4)Ϊ�����Һ�������غ����c(K+)=![]() =0.06mol/L��
=0.06mol/L��
c(H2C2O4)+c(HC2O4)+c(C2O42)��![]() =0.04mol/L������c(K+)+c(H2C2O4)+c(HC2O4)+c(C2O42)��0.10mol/L��
=0.04mol/L������c(K+)+c(H2C2O4)+c(HC2O4)+c(C2O42)��0.10mol/L��
��ˣ�������ȷ������c(K+)>c(HC2O4�D)>c(H+)>c(C2O42-)>c(OH-) �� 0.10��