题目内容
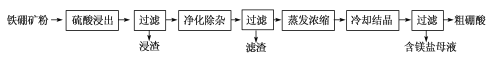
【题目】某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取。
实验(一) 碘含量的测定

取0.0100 mol·Lˉ1的AgNO3标准溶液装入滴定管,取100.00 mL海带浸取原液至滴定池,用电势滴定法测定碘含量。测得的电动势(E) 反映溶液中c(Iˉ)的变化,部分数据如下表:
V(AgNO3)/mL | 15.00 | 19.00 | 19.80 | 19.98 | 20.00 | 20.02 | 21.00 | 23.00 | 25.00 |
E/mV | -225 | -200 | -150 | -100 | 50.0 | 175 | 275 | 300 | 325 |
实验(二) 碘的制取
另制海带浸取原液,甲、乙两种实验方案如下:

已知:3I2+6NaOH=5NaI+NaIO3+3H2O。
请回答:
(1)①实验(一) 中的仪器名称:仪器A_________, 仪器 B_________。
②该次滴定终点时用去AgNO3溶液的体积为_____mL,计算得海带中碘的百分含量为_______%。
(2)①步骤X中,萃取后分液漏斗内观察到的现象是_______________。
②下列有关步骤Y的说法,正确的是___________________。
A.应控制NaOH溶液的浓度和体积
B.将碘转化成离子进入水层
C.主要是除去海带浸取原液中的有机杂质
D.NaOH溶液可以由乙醇代替
③实验(二) 中操作Z的名称是______________________。
(3)方案甲中采用蒸馏不合理,理由是_____________________。
【答案】坩埚 500mL容量瓶 20.00mL 0.635% 液体分上下两层,下层呈紫红色 AB 过滤 主要由于碘易升华,会导致碘的损失
【解析】
(1) ①根据仪器的构造分析,灼烧海带的仪器为坩埚,通过仪器B配制500mL含有碘离子的浸取溶液的仪器为500mL容量瓶。 ②通过表中数据分析,当加入20.00mL硝酸银溶液时,电动势出现了突变,说明滴定终点时消耗20.00mL硝酸银溶液。20.00mL硝酸银溶液中含有硝酸银的物质的量为0.0100mol/L×0.02L=0.0002mol,则500mL原浸出液完全反应消耗硝酸银的物质的量为0.001mol,说明20.00克该海带中含有0.001mol碘离子,所以海带中碘的百分含量为127g/mol×0.001mol/20.000g=0.635% 。 (2) ①碘单质易溶于有机溶剂,微溶于水,且四氯化碳的密度大于水,所以萃取后分液漏斗观察的现象为:液体分上下两层,下层呈紫红色 ;②A.发生反应3I2+6NaOH=5NaI+NaIO3+3H2O,需要浓氢氧化钠溶液,所以应控制氢氧化钠溶液的浓度和体积确保I2完全反应,同时减少后续实验使用硫酸的量,故正确;B.根据反应3I2+6NaOH=5NaI+NaIO3+3H2O可知,步骤Y将碘转化为离子进入水层,故正确;C.该操作的主要目的是将碘单质转化为碘酸钠、碘化钠,将碘转化为离子进入水层,不是除去有机杂质,故错误;D.乙醇易溶于水和四氯化碳,将氢氧化钠换成乙醇,仍然无法分离出碘单质,故错误。故选AB。③步骤Z将碘单质和水分离,由于碘单质不溶于水,可通过过滤操作完成。(3)方案甲中采用蒸馏操作,由于碘单质容易升华,会导致碘单质损失,所以甲方案不合理。

【题目】“碘钟”实验中,3I-+![]() ===
===![]() +2
+2![]() 的反应速率可以用
的反应速率可以用![]() 与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20 ℃进行实验,得到的数据如下表:
与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20 ℃进行实验,得到的数据如下表:
实验编号 | ① | ② | ③ | ④ | ⑤ |
c(I-1)/(mol·L-1) | 0.040 | 0.080 | 0.080 | 0.160 | 0.120 |
c( | 0.040 | 0.040 | 0.080 | 0.020 | 0.040 |
t/s | 88.0 | 44.0 | 22.0 | 44.0 | t2 |
回答下列问题:
(1)该实验的目的是__________________________________。
(2)上表中显色时间t2=________。
(3)温度对该反应的反应速率的影响符合一般规律,若在40 ℃下进行编号③对应浓度的实验,显色时间t2的范围为________(填字母)。
A.<22.0 s B.22.0~44.0 s C.>44.0 s D.数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是____________________________________。