题目内容
【题目】一定条件下,对于可逆反应X(g)+3Y(g)![]() 2Z(g),若X、Y、Z的起始浓度分别为c0(X)、c0(Y)、c0(Z)(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是( )
2Z(g),若X、Y、Z的起始浓度分别为c0(X)、c0(Y)、c0(Z)(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是( )
A. c0(X)∶c0(Y)=3∶1
B. 平衡时,Y和Z的生成速率之比为2∶3
C. X、Y的转化率不相等
D. c0(X)的取值范围为0 mol·L-1<c0(X)<0.14 mol·L-1
【答案】D
【解析】
A项,可根据反应转化关系和平衡浓度计算初始浓度关系;B项,达到平衡状态时,正逆反应速率相等;C项,起始量相同,平衡量相同,转化率相同;D项,根据可逆反应不能完全转化,利用极值转化法分析。
列出“三段式”浓度:
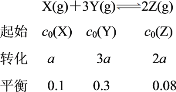
A项,c0(X)∶c0(Y)=(a+0.1)∶(3a+0.3)=1∶3,故A错误;B项,平衡时,正逆反应速率相等,v逆(Y)∶v正(Z)=3∶2,故B错误;C项,X、Y的转化率之比为:![]() ∶
∶![]() =1∶1,故C错误;D项,反应为可逆反应,物质不可能完全转化,如反应向逆反应方向进行,则c0(X)>0,如反应向正反应方向进行,则c0(X)<0.14molL-1,所以0<c0(X)<0.14molL-1,故D正确。综上所述,符合题意的选项为D。
=1∶1,故C错误;D项,反应为可逆反应,物质不可能完全转化,如反应向逆反应方向进行,则c0(X)>0,如反应向正反应方向进行,则c0(X)<0.14molL-1,所以0<c0(X)<0.14molL-1,故D正确。综上所述,符合题意的选项为D。

练习册系列答案
相关题目