题目内容
(11分)在常温下,下列五种溶液:
①0.1mol/L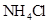 ②0.1mol/L
②0.1mol/L ③0.1mol/L
③0.1mol/L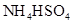
④0.1mol/L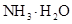 和0.1mol/L
和0.1mol/L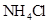 混合液 ⑤0.1mol/L
混合液 ⑤0.1mol/L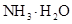
请根据要求填写下列空白:
(1)溶液①呈 性(填“酸”、“碱”或“中”),其原因是(用离子方程式表示)
____________________________________________________________________________。
(2)在上述五种溶液中,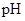 最小的是 ;
最小的是 ; 最小的是 (填序号)
最小的是 (填序号)
(3)比较溶液②、③中 的大小关系是② ③(填“>”、“<”或“=”)。
的大小关系是② ③(填“>”、“<”或“=”)。
(4)在溶液④中, 离子的浓度为0.1mol/L;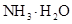 和 离子的物质的量浓度之和为0.2mol/L。
和 离子的物质的量浓度之和为0.2mol/L。
(5)常温下,测得溶液②的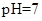 ,则说明
,则说明 的水解程度 (填“>”、“<”或“="”" )
的水解程度 (填“>”、“<”或“="”" ) 的水解程度,
的水解程度, 与
与 浓度的大小关系是:
浓度的大小关系是: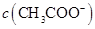
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
①0.1mol/L
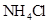 ②0.1mol/L
②0.1mol/L ③0.1mol/L
③0.1mol/L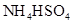
④0.1mol/L
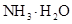 和0.1mol/L
和0.1mol/L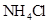 混合液 ⑤0.1mol/L
混合液 ⑤0.1mol/L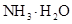
请根据要求填写下列空白:
(1)溶液①呈 性(填“酸”、“碱”或“中”),其原因是(用离子方程式表示)
____________________________________________________________________________。
(2)在上述五种溶液中,
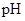 最小的是 ;
最小的是 ; 最小的是 (填序号)
最小的是 (填序号) (3)比较溶液②、③中
 的大小关系是② ③(填“>”、“<”或“=”)。
的大小关系是② ③(填“>”、“<”或“=”)。 (4)在溶液④中, 离子的浓度为0.1mol/L;
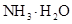 和 离子的物质的量浓度之和为0.2mol/L。
和 离子的物质的量浓度之和为0.2mol/L。 (5)常温下,测得溶液②的
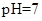 ,则说明
,则说明 的水解程度 (填“>”、“<”或“="”" )
的水解程度 (填“>”、“<”或“="”" ) 的水解程度,
的水解程度, 与
与 浓度的大小关系是:
浓度的大小关系是: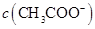
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(1)、酸(1分)、 NH4+ +H2O  NH3·H2O+ H+(3分);
NH3·H2O+ H+(3分);
(2)、③(1分),⑤(1分); (3)、<(1分);(4)、Cl-(1分), NH4+(1分);
(5)、 =(1分), =(1分)
 NH3·H2O+ H+(3分);
NH3·H2O+ H+(3分);(2)、③(1分),⑤(1分); (3)、<(1分);(4)、Cl-(1分), NH4+(1分);
(5)、 =(1分), =(1分)
(1)氯化铵是强酸弱碱盐,水解显酸性,方程式为NH4+ +H2O  NH3·H2O+ H+。
NH3·H2O+ H+。
(2)磷酸氢铵能电离出氢离子,酸性最强。氨水是弱电解质,存在电离平衡,所以⑤中 最小。
最小。
(3)硫酸氢钠显酸性,能抑制 的水解,所以③大于②。
的水解,所以③大于②。
(4)氯离子不水解,所以氯离子浓度是0.1mol/L。根据原子守恒可知,NH3·H2O和NH4+的浓度之和是0.2molL。
(5)常温下,测得溶液②的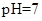 ,则说明
,则说明 的水解程度等于
的水解程度等于 的水解程度,所以
的水解程度,所以 与
与 浓度相等。
浓度相等。
 NH3·H2O+ H+。
NH3·H2O+ H+。(2)磷酸氢铵能电离出氢离子,酸性最强。氨水是弱电解质,存在电离平衡,所以⑤中
 最小。
最小。(3)硫酸氢钠显酸性,能抑制
 的水解,所以③大于②。
的水解,所以③大于②。(4)氯离子不水解,所以氯离子浓度是0.1mol/L。根据原子守恒可知,NH3·H2O和NH4+的浓度之和是0.2molL。
(5)常温下,测得溶液②的
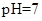 ,则说明
,则说明 的水解程度等于
的水解程度等于 的水解程度,所以
的水解程度,所以 与
与 浓度相等。
浓度相等。
练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 CH3COO- + H+
CH3COO- + H+