题目内容
常温下,将0.1 mol·L-1氢氧化钠溶液与0.06 mol·L-1硫酸溶液等体积混合,该混合溶液的pH等于( )
| A.1.7 | B.2.0 | C.12.0 | D.12.4 |
B
考查pH的计算。根据题意可知,硫酸是过量的,所以氢离子浓度=
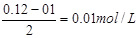 ,所以pH=2,答案选B。
,所以pH=2,答案选B。
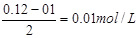 ,所以pH=2,答案选B。
,所以pH=2,答案选B。
练习册系列答案
相关题目
题目内容
| A.1.7 | B.2.0 | C.12.0 | D.12.4 |
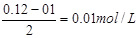 ,所以pH=2,答案选B。
,所以pH=2,答案选B。