题目内容
已知25℃时,Ka(HF)=3.6×10-4,Ksp(CaF2)=1.46×10-10。现向1 L 0.2 mol·L-1 HF溶液中加入1 L 0.2 mol·L-1 CaCl2溶液,则下列说法中,正确的是
| A.HF与CaCl2反应产生沉淀 |
| B.25℃时0.2mol·L-1HF溶液中pH=2 |
| C.Ksp(CaF2)随温度和浓度的变化而变化 |
| D.该体系中最终没有氟化氢分子 |
A
混合后氟离子和钙离子的浓度分别是6×10-3mol/L和0.1mol/L,此时c(F-)2·c(Ca2+)=3.6×10-5>.46×10-10,所以能产生沉淀,A正确。25℃时0.2mol·L-1HF溶液中氢离子浓度是8.5×10-3mol/L,B不正确。溶度积常数只与温度有关系,C不正确。氟化氢是弱电解质,始终存在电离平衡,即溶液中一定含有氟化氢分子,D不正确,答案选A。

练习册系列答案
相关题目

 ?OH-+H2S
?OH-+H2S 大致是5,其中的
大致是5,其中的 最接近于
最接近于



 的稀溶液中
的稀溶液中 已知
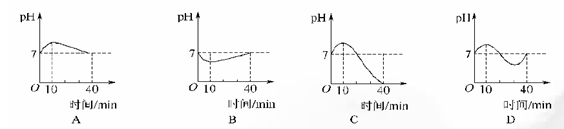
已知 向该溶液中逐滴加入PH=c的盐液,测得混合溶液的部分PH如下表所示
向该溶液中逐滴加入PH=c的盐液,测得混合溶液的部分PH如下表所示 溶液体积/ml
溶液体积/ml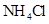 ②0.1mol/L
②0.1mol/L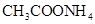 ③0.1mol/L
③0.1mol/L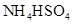
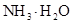 和0.1mol/L
和0.1mol/L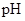 最小的是 ;
最小的是 ; 最小的是 (填序号)
最小的是 (填序号) 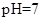 ,则说明
,则说明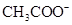 的水解程度 (填“>”、“<”或“="”" )
的水解程度 (填“>”、“<”或“="”" )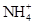 的水解程度,
的水解程度,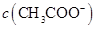
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。