题目内容
(10分)在一定温度下,醋酸溶液存在电离平衡:
CH3COOH CH3COO- + H+
CH3COO- + H+
(1)某温度时,0.1mol/L的醋酸溶液中的c(H+) 与0.01mol/L c(H+)的比值 _________________(填“大于”、“小于”或“等于”)10
(2)已知:25℃时,该电离平衡的平衡常数为1.75×10-5
①求该温度时,amol/L的醋酸溶液中c1(H+)="________________mol/L" (用含a的代数式表示)。[提示:此时a比较小,进行简化计算,平衡时c(CH3COOH)可用初始浓度代替,水电离出的c(H+) 、c(OH-)忽略不计,下同]
②若该温度时向该溶液中加入一定量的CH3COONH4(假设溶液体积不变),使溶液中c(CH3COO-)为bmol/L,则此时c2(H+)=________________mol/L(用含a、b的代数式表示).
③c1(H+)__________ c2(H+)(填“大于”、“小于”或“等于”)
CH3COOH
 CH3COO- + H+
CH3COO- + H+(1)某温度时,0.1mol/L的醋酸溶液中的c(H+) 与0.01mol/L c(H+)的比值 _________________(填“大于”、“小于”或“等于”)10
(2)已知:25℃时,该电离平衡的平衡常数为1.75×10-5
①求该温度时,amol/L的醋酸溶液中c1(H+)="________________mol/L" (用含a的代数式表示)。[提示:此时a比较小,进行简化计算,平衡时c(CH3COOH)可用初始浓度代替,水电离出的c(H+) 、c(OH-)忽略不计,下同]
②若该温度时向该溶液中加入一定量的CH3COONH4(假设溶液体积不变),使溶液中c(CH3COO-)为bmol/L,则此时c2(H+)=________________mol/L(用含a、b的代数式表示).
③c1(H+)__________ c2(H+)(填“大于”、“小于”或“等于”)
(10分)(1)< (2)① 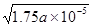 ②(1.75a×10-5)/b ③>
②(1.75a×10-5)/b ③>
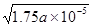 ②(1.75a×10-5)/b ③>
②(1.75a×10-5)/b ③>(1)醋酸是弱酸,存在电离平衡,所以浓度越大,电离程度越小,所以0.1mol/L的醋酸溶液中的c(H+) 与0.01mol/L c(H+)的比值小于10。
(2)①醋酸的电离方程式为CH3COOH CH3COO-+H+,所以根据醋酸的电离平衡常数表达式
CH3COO-+H+,所以根据醋酸的电离平衡常数表达式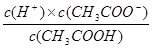 可知,氢离子浓度是c1(H+)=
可知,氢离子浓度是c1(H+)=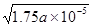 。
。
②根据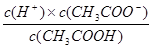 可知,此时氢离子浓度是
可知,此时氢离子浓度是
c2(H+)= 。
。
③由于醋酸铵能抑制醋酸的电离,所以c1(H+)大于 c2(H+)。
(2)①醋酸的电离方程式为CH3COOH
 CH3COO-+H+,所以根据醋酸的电离平衡常数表达式
CH3COO-+H+,所以根据醋酸的电离平衡常数表达式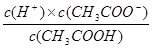 可知,氢离子浓度是c1(H+)=
可知,氢离子浓度是c1(H+)=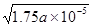 。
。②根据
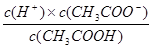 可知,此时氢离子浓度是
可知,此时氢离子浓度是c2(H+)=
 。
。③由于醋酸铵能抑制醋酸的电离,所以c1(H+)大于 c2(H+)。

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
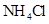 ②0.1mol/L
②0.1mol/L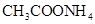 ③0.1mol/L
③0.1mol/L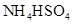
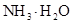 和0.1mol/L
和0.1mol/L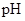 最小的是 ;
最小的是 ; 最小的是 (填序号)
最小的是 (填序号) 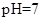 ,则说明
,则说明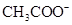 的水解程度 (填“>”、“<”或“="”" )
的水解程度 (填“>”、“<”或“="”" )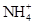 的水解程度,
的水解程度,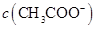
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。