题目内容
6.某物质的晶体中,含A、B、C三种元素,其排列方式如图所示(其中前后两面心上的B原子未画出).晶体中的A、B、C的原子个数比依次为( )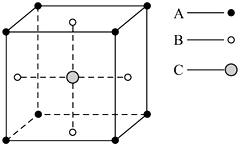
| A. | 1:3:1 | B. | 2:3:1 | C. | 2:2:1 | D. | 1:3:3 |
分析 利用均摊法计算该小正方体中各种原子个数,顶点上的原子被8个小正方体共用,面心上的原子被2个小正方体共用,体心上的原子被1个小正方体占有.
解答 解:根据图片知,该小正方体中A原子个数=8×$\frac{1}{8}$=1,B原子个数=6×$\frac{1}{2}$=3,C原子个数=1,所以晶体中A、B、C的原子个数比为1:3:1,
故选:A.
点评 本题考查了晶胞的计算,为高频考点,侧重于学生的分析能力的考查,明确顶点、棱、面心上每个原子被几个晶胞占有是解本题关键,难度中等.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
16.已知:CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ/mol相同温度下,在体积相同的两个恒温密闭容器中,加入一定量的反应物发生反应.相关数据如下:下列说法中,不正确的是( )
| 容器编号 | 起始时各物质物质的量/mol | 达平衡过程体系能量的变化 | |||
| CO | H2O | CO2 | H2 | ||
| ① | 1 | 4 | 0 | 0 | 放出热量:32.8 kJ |
| ② | 0 | 0 | 1 | 4 | 热量变化:Q |
| A. | 容器①中反应达平衡时,CO的转化率为80% | |
| B. | 容器①中CO的转化率等于容器②中CO2的转化率 | |
| C. | 容器①中CO反应速率等于H2O的反应速率 | |
| D. | 平衡时,两容器中CO2的浓度相等 |
17.2012年我国累计开通11条高速铁路.工程技术人员焊接铁轨时,利用了如下反应:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,其反应类型属于( )
| A. | 置换反应 | B. | 分解反应 | C. | 化合反应 | D. | 复分解反应 |
1.25℃时,下列说法正确的是( )
| A. | 0.1mol/LCH3COOH溶液中:c(CH3COO-)=c(H+) | |
| B. | 水离出来的c(H+)=l.0×10-13 mol/L的溶液中,Al3+可能大量存在 | |
| C. | 0.1 mol/LNaHCO3溶液中:c(Na+)=c(HCO3- )+2c(CO3 2-)+c(H2CO3) | |
| D. | O.lmol/L的氨水中滴加稀盐酸至过量,不可能有:c(Cl-)>c(NH4 +)>c(H+)>c(OH-) |
11.下列工业生产的主要反应中,涉及置换反应的是( )
| A. | 制取粗硅 | B. | 海水提镁 | C. | 电解制铝 | D. | 制备硫酸 |
15.第三周期元素中,基态原子轨道表示式中存在着空轨道的元素有( )种.
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
16.下列说法正确的是( )
| A. | 在100℃、101 kPa条件下,液态水的气化热为40.69 kJ•mol-1,则H2O(g)?H2O(l) 的△H=+40.69 kJ•mol-1 | |||||||||||
| B. | 已知MgCO3的Ksp=6.82×10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)•c(CO32-)=6.82×10-6 | |||||||||||
| C. | 已知:
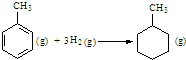 的△H为-384 kJ•mol-1 的△H为-384 kJ•mol-1 | |||||||||||
| D. | 常温下,在0.10 mol•L-1的NH3•H2O溶液中加入少量NH4Cl晶体,能使NH3•H2O的电离度降低,溶液的pH减小 |

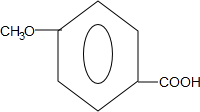 .
.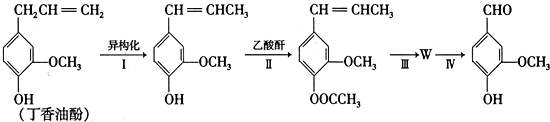
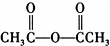 )
) 合成丁香油酚的反应类型为取代反应.
合成丁香油酚的反应类型为取代反应.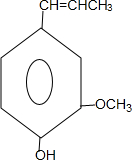 +CH3OCOCOCH3→
+CH3OCOCOCH3→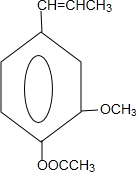 +CH3COOH
+CH3COOH .
.