题目内容
【题目】Na2O2可用作漂白剂和呼吸面具中的供氧剂
(1)某学习小组发现:在盛有Na2O2的试管中加入足量水,固体完全溶解,并立即产生大量气泡,当气泡消失后,向其中滴入1~2滴酚酞溶液,溶液变红;将试管轻轻振荡,红色很快褪去;此时再向试管中加入少量MnO2粉末,又有气泡产生。
①写出Na2O2作供氧剂的化学反应方程式____________;
②使酚酞溶液变红是因为________,红色褪去的可能原因是___________;
③加入MnO2反应的化学方程式为____________;
(2)Na2O2有强氧化性,H2具有还原性,有同学猜想Na2O2与H2能反应。为了验证此猜想,该小组同学进行加下实验,实验步骤和现象如下:
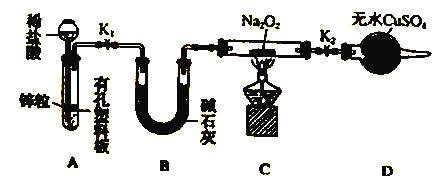
步骤1:按上图组装仪器(图中夹持仪器省略),检查气密性,装入药品。
步骤2:打开K1、K2,产生的氢气流经装有Na2O2的硬质玻璃管,一段时间后没有任何现象。
步骤3: ,开始加热,观察到硬质玻璃管内Na2O2开始熔化,淡黄色的粉末变成了白色固体,干燥管内硫酸铜未变蓝色。
步骤4:反应后撤去酒精灯,待硬质玻璃管冷却后关闭K1。
①添加稀盐酸的仪器名称是______,B装置的作用_________。
②步骤3在点燃C处酒精灯前必须进行的操作是______________;
③装置D的目的是_________;
④你得到的结论是________(若能反应请用化学方程式表示);
⑤该实验设计中存在着明显不足之处,应该如何改进:___________。
【答案】 2Na2O2 + 2CO2 = 2Na2CO3 + O2 (或写成2 Na2O2+2H2O=4NaOH+O2↑) 生成了碱(NaOH) 反应生成的H2O2具有漂白作用 ![]() 长颈漏斗 吸收氢气中的杂质气体或除去氢气中的水蒸气和氯化氢气体 检验氢气纯度 检验是否有水生成 Na2O2 + H2 = 2 NaOH 在装置D后连接一个氢气的尾气处理装置
长颈漏斗 吸收氢气中的杂质气体或除去氢气中的水蒸气和氯化氢气体 检验氢气纯度 检验是否有水生成 Na2O2 + H2 = 2 NaOH 在装置D后连接一个氢气的尾气处理装置
【解析】分析:(1)过氧化钠和水或二氧化碳反应生成氢氧化钠和氧气,反应中可能生成过氧化氢,过氧化氢具有氧化性,因此加入二氧化锰可以放出氧气;
(2)分析装置图和实验步骤可知,盐酸与锌反应生成的氢气中会混有氯化氢气体,氢气是可燃性气体,混有空气时点燃易发生爆炸;实验现象分析可知过氧化钠变为白色固体,硫酸铜不变蓝色证明无水生成,证明氢气和过氧化钠反应生成氢氧化钠。
详解:(1)①过氧化钠和水或二氧化碳反应生成氢氧化钠和氧气,反应的方程式为2 Na2O2+2H2O=4NaOH+O2↑或2Na2O2 + 2CO2 = 2Na2CO3 + O2,故答案为:2Na2O2 + 2CO2 = 2Na2CO3 + O2 (或写成2 Na2O2+2H2O=4NaOH+O2↑);
②氢氧化钠是碱,碱遇酚酞变红;红色褪去的可能原因是过氧化钠和水反应生成的过氧化氢具有氧化性,能氧化有色物质,故答案为:生成了碱(NaOH);反应生成的H2O2具有漂白作用;
③过氧化氢在二氧化锰做催化剂分解生成水和氧气,反应的化学方程式为:2H2O2![]() 2H2O+O2↑,故答案为:2H2O2
2H2O+O2↑,故答案为:2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
(2)①分析装置图和实验步骤可知,盛盐酸的仪器为长颈漏斗;B装置是吸收氢气中的杂质气体,除去氢气中的水蒸气等,故答案为:长颈漏斗;吸收氢气中的杂质气体;
②氢气是可燃性气体混有空气易点燃发生爆炸,点燃氢气前需要验纯,防止空气与氢气混合加热爆炸,故答案为:检验氢气纯度;
③D装置中装有无水硫酸铜,用来检验反应中是否有水产生,故答案为:检验反应中是否有水产生;
④实验现象分析可知过氧化钠变为白色固体,硫酸铜不变蓝色证明无水生成,证明氢气和过氧化钠反应生成氢氧化钠,反应的化学方程式为,Na2O2+H2![]() 2NaOH,故答案为:氢气和过氧化钠反应生成氢氧化钠,Na2O2+H2
2NaOH,故答案为:氢气和过氧化钠反应生成氢氧化钠,Na2O2+H2![]() 2NaOH;
2NaOH;
⑤氢气属于易燃气体,多余的氢气不能直接排放到空气中,需要在装置D后连接一个氢气的尾气处理装置,故答案为:在装置D后连接一个氢气的尾气处理装置。

【题目】工业上用含三价钒(V2O3)为主的某石煤为原料(含有Al2O3、CaO等杂质),钙化法焙烧制备V2O5,其流程如下:
![]()
【资料】:+5价钒在溶液中的主要存在形式与溶液pH的关系:
pH | 4~6 | 6~8 | 8~10 | 10~12 |
主要离子 | VO2+ | VO3 | V2O74 | VO43 |
(1)焙烧:向石煤中加生石灰焙烧,将V2O3转化为Ca(VO3)2的化学方程式是______。
(2)酸浸: ① Ca(VO3)2难溶于水,可溶于盐酸。若焙砂酸浸时溶液的pH=4,Ca(VO3)2溶于盐酸的离子方程式是______。
② 酸度对钒和铝的溶解量的影响如图所示:酸浸时溶液的酸度控制在大约3.2%,根据如图推测,酸浸时不选择更高酸度的原因是______。

(3)转沉:将浸出液中的钒转化为NH4VO3固体,其流程如下:
![]()
① 浸出液中加入石灰乳的作用是______。
② 已知CaCO3的溶解度小于Ca3(VO4)2。向Ca3(VO4)2沉淀中加入(NH4)2CO3溶液,可使钒从沉淀中溶出。结合化学用语,用平衡移动原理解释其原因:______。
③ 向(NH4)3VO4溶液中加入NH4Cl溶液,控制溶液的pH=7.5。当pH>8时,NH4VO3的产量明显降低,原因是______。
(4)测定产品中V2O5的纯度:
称取a g产品,先用硫酸溶解,得到(VO2)2SO4溶液。再加入b1 mL c1 mol·L1 (NH4)2Fe(SO4)2溶液(VO2+ + 2H+ + Fe2+ == VO2+ + Fe3+ + H2O)。最后用c2 mol·L1 KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2 mL。已知 MnO4被还原为Mn2+,假设杂质不参与反应。则产品中V2O5的质量分数是______。(V2O5的摩尔质量:182 g·mol1)