题目内容
【题目】C、Ti的单质及其化合物在现代社会有广泛用途。
(1)基态钛原子的电子排布式为________。
(2)CS2分子中含有σ键和π键之比为______;NO2+与CO2是等电子体,NO2+的电子式为___,键角为_______。
(3)CH3CHO沸点低于CH3CH2OH的原因是_____;CH3CHO分子中碳原子杂化类型为_____。
(4)钛酸钡(BaTiO3)晶体的某种晶胞如图所示。NA为阿伏加德罗常数值,Ba2+、O2-、Ti4+的半径分别为apm、bpm、cpm。
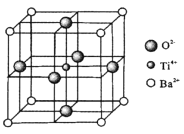
①与钡离子等距离且最近的氧离子有______个;
②假设晶体中的Ti4+、Ba2+分别与O2-互相接触,则该晶体的密度表达式为______g.cm-3。
【答案】 [Ar]3d24s2 1:1 ![]() 180° CH3CH2OH分之间存在氢键 sp2、sp3 12
180° CH3CH2OH分之间存在氢键 sp2、sp3 12 ![]() 或
或
【解析】(1)Ti为第22号元素,核外电子排布为[Ar]3d24s2。
(2)CS2和CO2是等电子体,所以结构相同,结构式为S=C=S,双键应该是一个σ键和一个π键,所以σ键和π键都是两个,比例为1:1。NO2+与CO2是等电子体,所以结构相似,因为二氧化碳的电子式为:![]() ,所以NO2+的电子式为
,所以NO2+的电子式为![]()
(3)CH3CHO沸点低于CH3CH2OH的原因是:乙醇有羟基,可以形成分子间氢键,从而提高物质的沸点。乙醛分子中,甲基碳形成4个单键,所以是sp3杂化,醛基碳形成了一个碳氧双键,所以是sp2杂化。
(4)①将晶胞的结构进行代换,以Ba2+为体心,以Ti4+为顶点得到新的晶胞,此时O2_在12条棱的棱心,所以与钡离子等距离且最近的氧离子有12个。
②由图示可得:晶胞中有1个BaTiO3,所以晶胞的质量为![]() ;钡离子与氧离子之间的距离为立方体晶胞的面对角线的一半,所以晶胞的边长为
;钡离子与氧离子之间的距离为立方体晶胞的面对角线的一半,所以晶胞的边长为![]() pm,即
pm,即![]() cm。 或者得到钛离子与阳离子之间的距离为晶胞边长的一半,得到晶胞边长为2(b+c)×10-10cm。晶体的密度等于晶胞质量除以晶胞体积,晶胞体积等于晶胞边长的立方,所以由上述数据得到晶体的密度为
cm。 或者得到钛离子与阳离子之间的距离为晶胞边长的一半,得到晶胞边长为2(b+c)×10-10cm。晶体的密度等于晶胞质量除以晶胞体积,晶胞体积等于晶胞边长的立方,所以由上述数据得到晶体的密度为![]() 或
或 。
。

【题目】控制变量是科学研究重要方法。由下列实验现象一定能得出相应结论的是
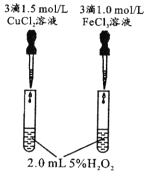
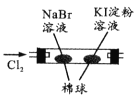
选项 | A | B |
装 置 图 |
|
|
现象 | 右边试管产生气泡较快 | 左边棉球变棕黄色,右边棉球变蓝色 |
结论 | 催化活性:Fe3+>Cu2+ | 氧化性:Br2>I2 |
选项 | C | D |
装 置 图 |
|
|
现象 | 试管中先出现淡黄色固体,后出现黄色固体 | 试管中液体变浑浊 |
结论 | Ksp:AgCl>AgBr>AgI | 非金属性:C>Si |
A. A B. B C. C D. D