题目内容
【题目】二茂铁[(C5H5)2Fe](橙黄色粉末,不溶于水,易溶于乙醚等有机溶剂)及其衍生物在工业、农业、医药、航天、节能、环保等行业具有广泛地应用。某校课外小组依据反应2KOH+2C5H6+FeCl2=(C5H5)2Fe+2KCl+2H2O在绝对无水、无氧的条件下制备二茂铁。
回答下列问题:
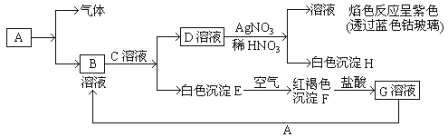
(1)甲组同学拟制备无水FeCl2,主要实验流程为:

步骤I用饱和Na2CO3溶液浸泡的目的是_______;步骤II 中铁屑是过量的,其目的是_____;步骤IV脱水的方法是____________。
(2)乙组用环戊二烯二聚体(沸点为174℃)制备环戊二烯(沸点为419℃),已知:(C5H6)2(环戊二烯二聚体)![]() 2C5H6(环戊二烯)。分离得到环戊二烯的操作方法为________。
2C5H6(环戊二烯)。分离得到环戊二烯的操作方法为________。
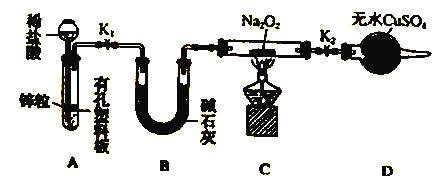
(3)丙组同学制备二茂铁的装置如图所示(夹持装置已略去)。

已知:二甲基亚砜的结构式为 ,热稳定性好,能溶解大多数有机物。
,热稳定性好,能溶解大多数有机物。
①图中冷却水从接口______进入(填“a”或“b”)。
②装药品前及整个过程需通入干燥的A,装药品前通入N2的目的是_________。
③反应后分离出上层橙黄色乙醚清液,先用盐酸洗涤,其目的是_______;再用水洗,水洗时能说明已洗涤干净的依据是_________;洗涤后得到的二茂铁乙醚溶液获得二茂铁固体可采用的操作方法是_____________。
【答案】 除去铁屑表而的油污 确保反应后的液体中不含Fe3+ 在HCl气流中加热脱水 蒸馏 a 排尽装置内空气 除去产品中溶解的KOH 取最后一次洗涤液水层中液体少许于试管中,滴入硝酸酸化的AgNO3溶液,无白色沉淀产生 蒸发结晶
【解析】(1)铁屑表面有油污,用饱和Na2CO3溶液浸泡可除去;Fe2+易被氧化为Fe3+,为防止溶液中含有Fe3+,步骤II中应使铁屑过量还原Fe3+;为防止氯化亚铁晶体在加热时发生水解,步骤IV脱水的方法是在HCl气流中加热脱水;综上,本题正确答案是: 除去铁屑表而的油污; 确保反应后的液体中不含Fe3+ ; 在HCl气流中加热脱水。
(2)已知:(C5H6)2(环戊二烯二聚体)![]() 2C5H6(环戊二烯),结合信息:环戊二烯二聚体(沸点为174℃)和环戊二烯(沸点为419℃),分离沸点不同的液体混合物的方法为蒸馏,因此,本题正确答案为:蒸馏。
2C5H6(环戊二烯),结合信息:环戊二烯二聚体(沸点为174℃)和环戊二烯(沸点为419℃),分离沸点不同的液体混合物的方法为蒸馏,因此,本题正确答案为:蒸馏。
(3)①在蒸馏装置中,冷凝管的冷凝水要从下口进上口出,故选a;
②由信息知:制备二茂铁需要在绝对无水、无氧的条件下,因此装药品前通入N2以排尽装置内空气;
③上层橙黄色乙醚清液,先用盐酸洗涤,可除去产品中溶解的KOH;再用水洗,可除去过量的盐酸,检验是否洗涤干净,可检查滤液中是否含有Cl-,采用的方法是:取最后一次洗涤液水层中液体少许于试管中,滴入硝酸酸化的AgNO3溶液,无白色沉淀产生,则说明洗涤干净;由于二茂铁易溶于乙醚,乙醚易挥发,故可采用蒸发结晶的操作方法;综合以上分析:本题正确答案为: 除去产品中溶解的KOH ;取最后一次洗涤液水层中液体少许于试管中,滴入硝酸酸化的AgNO3溶液,无白色沉淀产生; 蒸发结晶

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案【题目】控制变量是科学研究重要方法。由下列实验现象一定能得出相应结论的是
选项 | A | B |
装 置 图 |
|
|
现象 | 右边试管产生气泡较快 | 左边棉球变棕黄色,右边棉球变蓝色 |
结论 | 催化活性:Fe3+>Cu2+ | 氧化性:Br2>I2 |
选项 | C | D |
装 置 图 |
|
|
现象 | 试管中先出现淡黄色固体,后出现黄色固体 | 试管中液体变浑浊 |
结论 | Ksp:AgCl>AgBr>AgI | 非金属性:C>Si |
A. A B. B C. C D. D