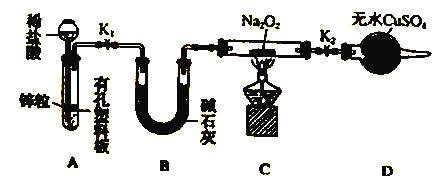
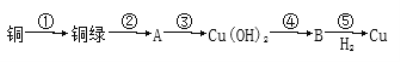
题目内容
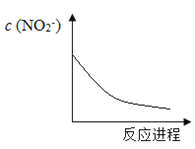
【题目】某离子反应涉及H2O、Cr2O72―、NO2―、H+、NO3―、Cr3+六种微粒,已知反应过程中NO2-浓度变化如图所示,下列说法不正确的是
A. Cr2O72-中Cr化合价是+6价
B. 反应的氧化产物是NO3-
C. 消耗1mol氧化剂,转移电子6mol
D. 随着反应的进行,溶液中的H+ 浓度增大
【答案】D
【解析】
本题主要考查氧化还原反应中相关计算。Cr2O72-具有强氧化性,NO2-具有还原性,二者发生氧化还原反应,所以发生的反应为:Cr2O72-+3NO2-+8H+===3NO3-+2Cr3++4H2O,以此解答。
A.该离子带两个单位负电荷,其中O为-2价,故Cr为+6价,正确;
B.N元素的化合价升高,被氧化,则反应的氧化产物是NO3-,正确;
C.反应中Cr的化合价从+6价降低到+3价,则消耗1mol Cr2O72-,转移电子6mol,正确;
D.由上述离子反应方程式可知,反应不断消耗H+,故随着反应的进行,溶液中的H+浓度减小,错误。

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目