题目内容
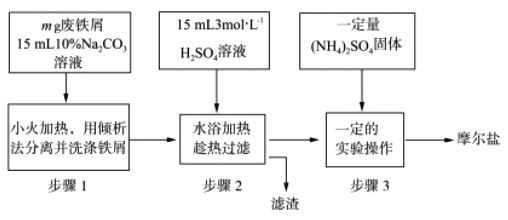
【题目】摩尔盐易溶于水,具有还原性。以下是利用废铁屑、稀硫酸和硫酸铵为原料制取摩尔盐的流程图。
回答下列问题:
(1)在“步骤1”中加Na2CO3溶液目的是_________________________。
(2)“步骤2”中所用废铁屑必须过量,原因是_______________________________。
(3)一般采用滴定法测定摩尔盐产品中Fe2+的含量:称取4.0 g摩尔盐样品,溶于水,加入适量稀硫酸,用0.2 mol·L-1 KMnO4溶液滴定,达到终点时,消耗10.00 mL KMnO4溶液。
①滴定过程中发生反应的离子方程式为_____________________________________。
②产品中Fe2+的质量分数为_________。
③滴定过程中,左手控制_________,(填“酸式”或“碱式”) 滴定管的活塞,右手摇动锥形瓶,直到________时停止滴定,读数。
【答案】 除去废铁屑表面的油污 防止产生Fe3+,保证所制摩尔盐的纯度 5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O 14% 酸式 滴入最后一滴KMnO4溶液,溶液出现浅紫色且半分钟内不褪色
【解析】(1)Na2CO3溶液中CO32-水解CO32-+H2OHCO3-+OH-,溶液显碱性,因此在“步骤1”中加Na2CO3溶液目的是除去废铁屑表面的油污;(2)为防止产生Fe3+,保证所制摩尔盐的纯度,步骤2中铁过量;(3)①高锰酸根氧化亚铁离子为铁离子,自身被还原为锰离子,离子方程式为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;②假设4.0产品中Fe2+的物质的量为xmol,则:
5Fe2+~~MnO4-
5 1
xmol 0.01L×0.2mol/L
则x=0.01mol,产品中Fe2+的质量为0.01mol×56g/mol=0.56g,产品中Fe2+的质量分数为0.56/4×100%=14%;③滴定过程中,左手控制酸式滴定管的活塞,右手摇动锥形瓶,直到溶液出现浅紫色且半分钟内不褪色时停止滴定。

 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案