题目内容
【题目】(1)给定条件下的下列四种物质:①标准状况下112mL液态水,②含有40mol电子的NH3, ③含有16NA个共价键的乙醇,④4g氦气,
则上述物质中所含分子数目由多到少的顺序是________________(填序号)。
(2)标准状况下,0.51g某气体的体积为672mL,则该气体相对分子质量为______。
(3)将100mLH2SO4和HCl混合溶液分成两等份,一份中加入含0.2molNaOH溶液时恰好中和完全,向另一份中加入含0.05molBaCl2溶液时恰好沉淀完全,则原溶液中c(Cl-)=_________。
(4)标准状况下,VL氨气溶解在1L水中(水的密度近似为1g/mL),所得溶液密度为ρg/mL,则所得溶液溶质物质的量浓度=________________mol/L。
(5)如图所示一密闭容器被中间隔板分成左右两部分,中间隔板可以自由移动,保持两边温度相同且不变,向左右两边分别各冲入1molN2、1molNO2(纯净),右边发生2NO2![]() N2O4,一段时间后,中间隔板距离右边2/5处,则右边气体中NO2体积分数为______________。
N2O4,一段时间后,中间隔板距离右边2/5处,则右边气体中NO2体积分数为______________。
![]()
【答案】 ①>②>③>④ 17 2mol/L 1000ρv/(17v+22400) 50%
【解析】(1)①标准状况下112mL液态水约为112g,含水分子物质的量为:![]() mol=6
mol=6![]() mol;②NH3是10电子分子,含有40mol电子的NH3物质的量为:
mol;②NH3是10电子分子,含有40mol电子的NH3物质的量为:![]() mol=4mol;③1mol乙醇含有8NA个共价键,含有16NA个共价键的乙醇的物质的量为:2mol;④4g氦气物质的量是1mol。则上述物质中所含分子数目由多到少的顺序是:①>②>③>④。
mol=4mol;③1mol乙醇含有8NA个共价键,含有16NA个共价键的乙醇的物质的量为:2mol;④4g氦气物质的量是1mol。则上述物质中所含分子数目由多到少的顺序是:①>②>③>④。
(2)标准状况下672mL该气体的物质的量为:0.672L÷22.4Lmol-1=0.03mol,又因为质量为0.51g,所以相对分子质量为:0.51÷0.03=17。
(3)由题意,反应为:OH-+H+=H2O、SO42-+Ba2+=BaSO4↓,所以H+的物质的量为0.2mol,SO42-的物质的量为0.05mol,根据电荷守恒,n(Cl-)=0.2mol-0.05mol×2=0.1mol,则原溶液中c(Cl-)=0.1mol÷0.05L=2molL-1。
(4)所得溶液中溶质的物质的量浓度= 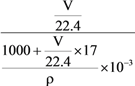 molL-1=
molL-1=![]() molL-1。
molL-1。
(5)根据题意,右边平衡后气体为![]() mol,设NO2为xmol,列三段式:
mol,设NO2为xmol,列三段式:

所以,x+![]() =
=![]() ,解得x=
,解得x=![]() ,所以NO2体积分数为50%。
,所以NO2体积分数为50%。