题目内容
【题目】《物质结构与性质》
(1)下列粒子的立体构型不是平面三角形的是___________。
A.CO32- B.NH3 C.BF3 D.SO3
(2)下列分子中,属于含极性键的非极性分子的是___________。
A.CH4 B.H2S C.C60 D.HCl
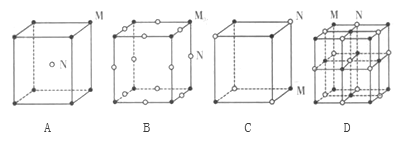
(3)现有四种离子晶体的晶胞,其离子排列方式如下列图所示,其中化学式不属于Mn型的是______。
(4)联合制碱法又称侯氏制碱法,其原理为:第一步NaCl+ NH3 + CO2+H2O=NaHCO3 + NH4Cl,第二步加热NaHCO3使其分解。关于第一步反应所包含的各物质中:
①属于离子化合物的是_________________(填化学式);
②中心原子是sp杂化的分子是_________________(填化学式);
③NaCl晶体中Na+的配位数为___________;
④写出H2O的任意一种等电子体的化学式___________。
(5)周期表前四周期的五种元素a、b、c、d、e,其核电荷数依次增大。a原子的核外电子总数与其周期数相同,b原子的最外层电子中有3个未成对电子,c原子的最外层电子数是其内层电子数的3倍,d与c同主族,e的价电子排布为3d104s1。
①b、c元素的第一电离能大小为:b _______c(填“>"或“<”)
②d的基态原子的电子排布式为___________; a2d的VSKPK模型为___________。
③ba3和a2c两种分子键角较大的是___________;ba3极易溶于a2c的原因,除了两种分子都是极性
分子外,还因为____________________________。
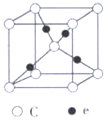
④e和c能形成一种化合物,其晶胞结构如右图所示,若设阿伏伽德罗常数值为NA,晶体的密度为d g/cm3,则晶胞参数a= _______nm(用含d、NA的代数式表示)。
【答案】 B A B NaCl、NaHCO3、NH4Cl CO2 6 H2S > 1s22s22p63s23p4 四面体 ba3(“NH3”同样给分) NH3与H2O分子间形成氢键,NH3与H2O发生化学反应 2×107![]() 或
或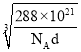
【解析】(1)A.C形成3个δ键,孤对电子数为![]() =0,为sp2杂化,立体构型为平面三角形,故A不选;B.NH3分子中,N原子成3个σ键,价层电子对个数=3+
=0,为sp2杂化,立体构型为平面三角形,故A不选;B.NH3分子中,N原子成3个σ键,价层电子对个数=3+![]() ×(5-3×1)=4,故杂化轨道数为4,杂化方式sp3,价层电子对互斥模型为四面体形,含有一个孤电子对,分子的立体构型为三角锥形,故选B;C.B形成3个δ键,孤对电子数为
×(5-3×1)=4,故杂化轨道数为4,杂化方式sp3,价层电子对互斥模型为四面体形,含有一个孤电子对,分子的立体构型为三角锥形,故选B;C.B形成3个δ键,孤对电子数为![]() =0,为sp2杂化,立体构型为平面三角形,故C不选;D.S形成3个δ键,孤对电子数为
=0,为sp2杂化,立体构型为平面三角形,故C不选;D.S形成3个δ键,孤对电子数为![]() =0,为sp2杂化,立体构型为平面三角形,故D不选;答案为B;
=0,为sp2杂化,立体构型为平面三角形,故D不选;答案为B;
(2)A.CH4含有H-C极性键,空间构型为正四面体,结构对称且正负电荷的中心重合,为非极性分子,故A正确;B.H2S含有H-S极性键,分子构型为V型,正负电荷的中心不重合,为极性分子,故B错误;C.C60含有C-C非极性键,正负电荷的中心重合,为非极性分子,故C错误;D.HCl含有H-Cl极性键,正负电荷的中心不重合,为极性分子,故D错误;故选A。
(3)A.晶胞中M位于顶点,晶胞平均含有A为8×![]() =1,N位于晶胞的体心,含有1个,则化学式为MN,故A不选;B.晶胞中M位于顶点,晶胞平均含有A为8×
=1,N位于晶胞的体心,含有1个,则化学式为MN,故A不选;B.晶胞中M位于顶点,晶胞平均含有A为8×![]() =1,N位于晶胞的棱,含有N为12×
=1,N位于晶胞的棱,含有N为12×![]() =3,化学式不属MN型,故B选;C.M、N各位于晶胞的顶点,各占4×
=3,化学式不属MN型,故B选;C.M、N各位于晶胞的顶点,各占4×![]() =
=![]() ,化学式为MN,故C不选;D.M位于晶胞的顶点和面心,共有8×
,化学式为MN,故C不选;D.M位于晶胞的顶点和面心,共有8×![]() +6×
+6×![]() =4,N位于晶胞的棱和体心,共有12×
=4,N位于晶胞的棱和体心,共有12×![]() +1=4,化学式为MN,故D不选;故选B。
+1=4,化学式为MN,故D不选;故选B。
(4)联合制碱法又称侯氏制碱法,其原理为:第一步NaCl+ NH3 + CO2
①NaCl、NaHCO3和NH4Cl均属于离子化合物;
②NH3 和H2O中心原子均为sp3杂化,而 CO2中心原子均为sp;
③以钠离子为中心,沿X、Y、Z三轴进行切割,上下左右前后,结合图片知,钠离子的配位数是6;
④根据等电子体理论,H2S与H2O是等电子体;
(5)周期表前四周期的元素a、b、c、d、e,原子序数依次增大,a的核外电子总数与其周期数相同,则a是H元素;c的最外层电子数为其内层电子数的3倍,原子最外层电子数是6,所以c是O元素;d与c同族,则d是S元素;b的价电子层中的未成对电子有3个,且原子序数小于c,则b是N元素;e的价电子排布为3d104s1,其核电荷数应为29,则e是Cu元素;
①b、c分别是N、O元素,为同周期元素,第一电离能随着原子序数的增大呈增大趋势,但N的p轨道为半充满结构,第一电离能相对较大,N、O第一电离能为N>O;
② S的核电荷数为16,其基态原子的电子排布式为1s22s22p63s23p4; H2S分子 S原子为sp3杂化,则VSKPK模型为四面体;
③ NH3为三角锥形,键角为107°,③H2O为V形,键角为105°,NH3和H2O两种分子键角较大的是NH3;NH3极易溶于H2O的原因,除了两种分子都是极性分子外,还因为NH3与H2O分子间形成氢键,NH3与H2O发生化学反应;
④Cu和O能形成一种化合物,其晶胞结构如右图所示,则晶胞中含有Cu原子数为4,而O原子数为8×![]() +1=2,则化学式为Cu2O,晶胞的质量为
+1=2,则化学式为Cu2O,晶胞的质量为![]() g=
g=![]() g,设晶胞的边长为anm,则晶胞的体积为(a3×10-21)cm3,则(a3×10-21)cm3=
g,设晶胞的边长为anm,则晶胞的体积为(a3×10-21)cm3,则(a3×10-21)cm3=![]() g÷d g/cm3,故a=
g÷d g/cm3,故a=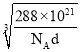
nm。

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案