题目内容
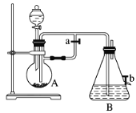
【题目】如图所示装置,可用来制取和观察Fe(OH)2在空气中被氧化过程中的颜色变化。实验时必须使用铁屑和6 mol·L1的硫酸,其他试剂任选。
请回答下列问题:
(1)B中盛有一定量的NaOH溶液,A中应预先加入的物质是__________________,A中反应的离子方程式是____________________________________________________。
(2)实验开始时应先将活塞a________(填“打开”或“关闭”)。其目的是____________________。
(3)简述生成Fe(OH)2的操作过程:__________________________________________。
(4)实验完毕,打开b处活塞,放入一部分空气,此时B中发生反应的化学方程式为_________________。
(5)图中________(填“能”或“不能”)较长时间看到Fe(OH)2白色沉淀。
【答案】铁屑 Fe+2H+===Fe2++H2↑打开排出装置中的空气首先打开a,让分液漏斗中酸液流下,使A中产生的H2通入B中,一段时间后关闭a,烧瓶中压强增大,A中液体沿导管流入B中,产生少量白色沉淀4Fe(OH)2+O2+2H2O===4Fe(OH)3能
【解析】
打开活塞a,先在烧瓶A中加入Fe粉,通过分液漏斗向烧瓶A中滴加无挥发性的稀硫酸,这时发生反应:Fe+2H +=Fe2++H2↑。产生的氢气把锥形瓶B中是NaOH溶液里的空气驱赶掉。使B中处于氢气的环境中。关闭活塞b。再关闭活塞a, 由于A中不断产生氢气,使得A中的压强越来越大。这时A中产生的氢气将A装置中的FeSO 4溶液通过导气管压入B中,发生反应Fe2++2OH -=Fe(OH) 2↓。由于整个装置都处于H 2的还原性环境中,所以可以较长时间的观察的Fe(OH) 2的白色沉淀。当实验完毕,打开b处活塞,空气进入到装置B中,此时B瓶中发生反应的化学方程式为:4Fe(OH) 2+O 2+2H 2O=4Fe(OH) 3。会看到:白色沉淀逐渐变成灰绿色,最后变成红褐色;说明Fe(OH) 2不稳定,容易被空气中的氧气氧化为红褐色的Fe(OH)3。
(1) 打开活塞a,先在烧瓶A中加入Fe粉,通过分液漏斗向烧瓶A中滴加无挥发性的稀硫酸,这时发生反应:Fe+2H+=Fe2++H2↑;
(2) 打开活塞a,先在烧瓶A中加入Fe粉,通过分液漏斗向烧瓶A中滴加无挥发性的稀硫酸,产生的氢气把锥形瓶B中是NaOH溶液里的空气驱赶掉;
(3) 首先打开a,让分液漏斗中酸液流下,使A中产生的H2通入B中,一段时间后关闭a,烧瓶中压强增大,A中液体沿导管流入B中,产生少量白色沉淀;
(4) 当实验完毕,打开b处活塞,空气进入到装置B中,此时B瓶中发生反应的化学方程式为:4Fe(OH) 2+O 2+2H 2O=4Fe(OH) 3;
(5) 首先打开a,让分液漏斗中酸液流下,使A中产生的H2通入B中,一段时间后关闭a,烧瓶中压强增大,A中液体沿导管流入B中,产生少量白色沉淀,此时仪器中不含有氧气,因此能较长时间看到Fe(OH)2白色沉淀。

 习题精选系列答案
习题精选系列答案