题目内容
3.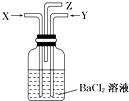 碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y 同时通入盛有足量氯化钡溶液的洗气瓶中(如图所示),下列有关说法正确的是( )
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y 同时通入盛有足量氯化钡溶液的洗气瓶中(如图所示),下列有关说法正确的是( )| A. | 洗气瓶中产生的沉淀是碳酸钡 | B. | 在Z导管出来的气体中无二氧化碳 | ||
| C. | 洗气瓶中产生的沉淀是硫酸钡 | D. | 在Z导管口有红棕色气体出现 |
分析 碳与浓硫酸共热产生的X气体为CO2和SO2的混合气体,铜与浓硝酸反应产生的Y气体是NO2,同时通入时因NO2与水和SO2共同作用要产生SO42-和NO,NO在空气中又会生成NO2,以此解答该题.
解答 解:X是CO2和SO2的混合气,Y为NO2,XY混合之后SO2和NO2会发生氧化还原反应:SO2 +NO2+H2O=H2SO4+NO,
A.因H2SO4能与氯化钡反应生成BaSO4,CO2与氯化钡不反应,没有BaCO3生成,故A错误;
B.因CO2不与氯化钡反应,从导管中逸出,所以在Z导管出来的气体中有二氧化碳,故B错误;
C.因H2SO4能与氯化钡反应生成BaSO4,故C正确;
D.因NO在空气中又会生成NO2,在Z导管口有红棕色气体出现,故D正确;
故选CD.
点评 本题考查物质的性质及实验装置的综合,为高频考点,把握物质的性质、发生的反应等为解答的关键,侧重分析与实验能力的考查,注意判断发生的氧化还原反应,题目难度不大.

练习册系列答案
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
8.下列叙述正确的是( )
| A. | 甲醇(CH3OH)和乙醇互为同系物 | |
| B. | 不同元素的原子构成的分子只能含极性共价键 | |
| C. | ${\;}_{92}^{235}$U和${\;}_{92}^{238}$U是中子数不同质子数相同的同种核素 | |
| D. | 短周期第IVA与VIIA族元素的原子间构成的分子,均不满足原子最外层8电子结构 |
15.下列说法或做法错误的是( )
| A. | 可以用无水CuSO4检验酒精中是否含水 | |
| B. | 煤的干馏过程是复杂的物理和化学过程 | |
| C. | 标准状况下,22.4L二氯甲烷的分子数约为NA个 | |
| D. | 用浸泡过高锰酸钾溶液的硅土吸收水果释放的乙烯,可达到水果保鲜的目的 |
12.一定温度下,在某密闭容器中发生反应:2HI(g)?H2(g)+I2(s)△H>0,若 0~15s 内 c(HI)由 0.1mol,•L-1 降到 0.07mol•L-1,则下列说法正确的是( )
| A. | 0~15 s 内用 I2 表示的平均反应速率为:v(I2)=0.001 mol•L-1•s-1 | |
| B. | c(HI)由 0.07 mol•L-1 降到 0.05 mol•L-1 所需的反应时间小于 10 s | |
| C. | 升高温度正反应速率加快,逆反应速率减慢 | |
| D. | 减小反应体系的体积,化学反应速率加快 |
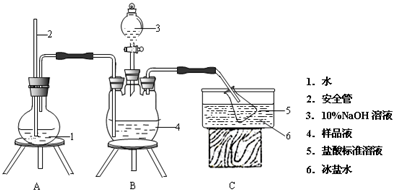
 如图所示为中学化学实验中几种常见仪器的部分结构:
如图所示为中学化学实验中几种常见仪器的部分结构:





 (并用双线桥标出电子转移的方向和数目),其中氧化产物为Ca(ClO)2(写化学式).
(并用双线桥标出电子转移的方向和数目),其中氧化产物为Ca(ClO)2(写化学式).