题目内容
【题目】以煤、天然气和生物质为原料制取有机化合物日益受到重视。E是两种含有碳碳双键的酯的混合物。相关物质的转化关系如下(含有相同官能团的有机物通常具有相似的化学性质):

请回答:
(1) A→B的反应类型________,C中含氧官能团的名称________。
(2) C与D反应得到E的化学方程式________。
(3) 检验B中官能团的实验方法________。
【答案】氧化反应 羧基 ![]() +CH2=CHCOOH
+CH2=CHCOOH![]()
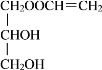 +H2O
+H2O ![]() +CH2=CHCOOH
+CH2=CHCOOH![]()
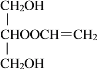 +H2O 加过量银氨溶液,加热,出现银镜,说明有醛基;用盐酸酸化,过滤,滤液中加入溴水,若溴水褪色,说明有碳碳双键
+H2O 加过量银氨溶液,加热,出现银镜,说明有醛基;用盐酸酸化,过滤,滤液中加入溴水,若溴水褪色,说明有碳碳双键
【解析】
B到C发生氧化反应,醛基被氧化成羧基,C为![]() ,油脂在酸性条件下水解得到高级脂肪酸和甘油,结合D的分子式,可知D为甘油
,油脂在酸性条件下水解得到高级脂肪酸和甘油,结合D的分子式,可知D为甘油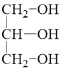 ,C和D发生酯化反应得到E,结合E的分子式可知-OH和-COOH发生1:1酯化,混合物E的结构简式为
,C和D发生酯化反应得到E,结合E的分子式可知-OH和-COOH发生1:1酯化,混合物E的结构简式为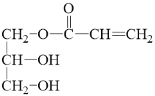 和
和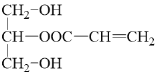 。
。
(1)根据分子组成的变化,即去氢加氧,A到B的反应类型为氧化反应,C中的含氧官能团为羧基。
(2)由上分析混合物E的结构简式,可知C和D的酯化反应得到两种有机产物,因而化学方程式分别为![]() +CH2=CHCOOH
+CH2=CHCOOH![]()
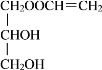 +H2O和
+H2O和![]() +CH2=CHCOOH
+CH2=CHCOOH![]()
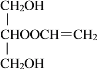 +H2O。
+H2O。
(3)B中含有碳碳双键和醛基,两者都易被氧化,其中醛基能被弱氧化剂氧化,因而需要先检验醛基,可采用银氨溶液检验,注意这里需要加过量的银氨溶液以便将醛基全部氧化,然后用盐酸酸化,原因在于银氨溶液呈碱性,能和溴水反应,然后将过滤后的滤液加入溴水,观察现象。因而答案为加过量银氨溶液,加热,出现银镜,说明有醛基;用盐酸酸化,过滤,滤液中加入溴水,若溴水褪色,说明有碳碳双键。

【题目】大气中CO2含量的增加会加剧温室效应,为减少其排放,需将工业生产中产生的CO2分离出来进行储存和利用。
(1)CO2溶于水生成碳酸,碳酸和亚硝酸(HNO2)的电离常数如下表所示,下列事实中,能说明亚硝酸酸性比碳酸强的是(填字母代号)____________。
弱酸 | HNO2 | H2CO3 |
电离常数 | Ka=5.1×10-4 | Ka1=4.6×10-7 |
Ka2=5.6×10-11 |
A 常温下,亚硝酸电离常数比碳酸一级电离常数大
B 亚硝酸的氧化性比碳酸的氧化性强
C 亚硝酸与碳酸钠反应生成CO2
D 相同浓度的碳酸钠溶液的pH比亚硝酸钠的大
(2).CO2与NH3反应可合成尿素[化学式为CO(NH2)2],反应2NH3(g)+CO2(g)CO(NH2)2(1)+H2O(g)在合成塔中进行,图中Ⅰ,Ⅱ,Ⅲ三条曲线分别表示温度为T℃时,按不同氨碳比![]() 和水碳比
和水碳比![]() 投料时,二氧化碳平衡转化率的情况。
投料时,二氧化碳平衡转化率的情况。

①曲线Ⅰ,Ⅱ,Ⅲ中水碳比的数值分别为0.6~0.7,1~1.1,1.5~1.6,则生产中应选用的水碳比数值范围是____________。
②推测生产中氨碳比应控制在____________(选填“4.0”或“4.5”)左右比较适宜。
③若曲线Ⅱ中水碳比为1,初始时CO2的浓度为1mol/L,则T℃时该反应的平衡常数K=____________(保留有数数字至小数点后两位)。
(3)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化为乙酸,请写出该反应的化学方程式:____________。在不同温度下催化剂的催化效率与乙酸的生成速率的关系如图所示。在温度为____________时,催化剂的活性最好,效率最高。请解释图中250~400℃时乙酸生成速率变化的原因:250~300℃时____________;300~400℃时____________。

【题目】取一定质量的NaBr、NaI的混合物平均分成四等份,分别加水配成溶液并编号甲、乙、丙、丁。再分别向各溶液中通入一定体积的氯气。将反应后所得溶液蒸干、灼烧的固体质量列表如下:
编号 | 甲 | 乙 | 丙 | 丁 |
固体成分 | NaCl、NaBr、NaI | NaCl、NaBr、NaI | NaCl、NaBr | NaCl |
Cl2体积/mL | V | 2V | 3V | 4V |
固体质量/g | 77.3 | 59.0 | 45.4 | 40.95 |
(1)在标准状况下,Cl2的体积V为___________mL。
(2)原混合物中NaBr的物质的量为__________mol。


