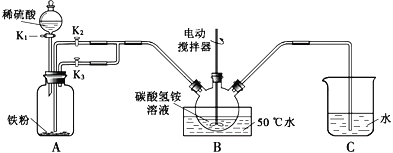
题目内容
【题目】大气中CO2含量的增加会加剧温室效应,为减少其排放,需将工业生产中产生的CO2分离出来进行储存和利用。
(1)CO2溶于水生成碳酸,碳酸和亚硝酸(HNO2)的电离常数如下表所示,下列事实中,能说明亚硝酸酸性比碳酸强的是(填字母代号)____________。
弱酸 | HNO2 | H2CO3 |
电离常数 | Ka=5.1×10-4 | Ka1=4.6×10-7 |
Ka2=5.6×10-11 |
A 常温下,亚硝酸电离常数比碳酸一级电离常数大
B 亚硝酸的氧化性比碳酸的氧化性强
C 亚硝酸与碳酸钠反应生成CO2
D 相同浓度的碳酸钠溶液的pH比亚硝酸钠的大
(2).CO2与NH3反应可合成尿素[化学式为CO(NH2)2],反应2NH3(g)+CO2(g)CO(NH2)2(1)+H2O(g)在合成塔中进行,图中Ⅰ,Ⅱ,Ⅲ三条曲线分别表示温度为T℃时,按不同氨碳比![]() 和水碳比
和水碳比![]() 投料时,二氧化碳平衡转化率的情况。
投料时,二氧化碳平衡转化率的情况。
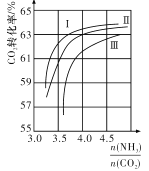
①曲线Ⅰ,Ⅱ,Ⅲ中水碳比的数值分别为0.6~0.7,1~1.1,1.5~1.6,则生产中应选用的水碳比数值范围是____________。
②推测生产中氨碳比应控制在____________(选填“4.0”或“4.5”)左右比较适宜。
③若曲线Ⅱ中水碳比为1,初始时CO2的浓度为1mol/L,则T℃时该反应的平衡常数K=____________(保留有数数字至小数点后两位)。
(3)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化为乙酸,请写出该反应的化学方程式:____________。在不同温度下催化剂的催化效率与乙酸的生成速率的关系如图所示。在温度为____________时,催化剂的活性最好,效率最高。请解释图中250~400℃时乙酸生成速率变化的原因:250~300℃时____________;300~400℃时____________。
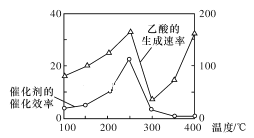
【答案】AC 0.6~0.7 4.0 0.59 ![]() 250℃ 催化剂效率下降是影响乙酸生成速率的主要原因 温度升高是影响乙酸生成速率的主要原因
250℃ 催化剂效率下降是影响乙酸生成速率的主要原因 温度升高是影响乙酸生成速率的主要原因
【解析】
(1)A、相同条件下,酸的电离平衡常数越大,酸性越强,根据表中数据,HNO2的电离平衡常数大于碳酸的一级电离常数,说明HNO2的酸性强于H2CO3,故A符合题意;
B、氧化性强弱与酸性强弱无关,故B不符合题意;
C、利用酸性强的制取酸性弱的,亚硝酸与碳酸钠反应生成CO2,说明亚硝酸的酸性强于碳酸,故C符合题意;
D、利用越弱越水解,Na2CO3对应的是HCO3-,NaNO2对应的是HNO2,相同浓度碳酸钠溶液的pH比亚硝酸的大,说明HCO3-电离出H+能力弱于HNO2,不能说明HNO2和H2CO3的酸性强弱,故D不符合题意;
(2)①氨碳比相同时,曲线I的CO2的转化率大,因此生产中选用水碳比数值范围是0.6~0.7;
②氨碳比在4.5时,需要氨气较多,根据图像分析,CO2的转化率增大不多,提高生产成本,所以氨碳比控制在4.0左右;
③曲线Ⅱ中水碳比为1,初始时CO2浓度为1mol·L-1,则c(H2O)=1mol·L-1,氨碳比为4时,CO2的转化率为63%,c(NH3)=4mol·L-1,则
2NH3+CO2![]() CO(NH2)2+H2O,
CO(NH2)2+H2O,
起始: 4 1 1
变化: 1.26 0.63 0.63
平衡: 2.74 0.37 1.63
平衡常数K=![]() ≈0.59;
≈0.59;
(3)CO2和CH4发生反应:CO2+CH4![]() CH3COOH;根据图像,当温度为250℃时,乙酸的生成速率最大,催化剂的催化效率最大;在250℃~300℃过程中,催化剂是影响速率的主要因素,因此催化效率的降低,导致反应速率也降低;而在300℃~400℃时催化效率低且变化程度小,但反应速率增加较明显,因此该过程中温度是影响速率的主要因素,温度越高,反应速率越大。
CH3COOH;根据图像,当温度为250℃时,乙酸的生成速率最大,催化剂的催化效率最大;在250℃~300℃过程中,催化剂是影响速率的主要因素,因此催化效率的降低,导致反应速率也降低;而在300℃~400℃时催化效率低且变化程度小,但反应速率增加较明显,因此该过程中温度是影响速率的主要因素,温度越高,反应速率越大。

【题目】X、Y、Z、W为短周期元素,若W原子的最外层电子数是其内层电子的![]() ,如图所示,下列说法不正确的是
,如图所示,下列说法不正确的是
X | Y | |
Z | W |
A.X元素的氢化物分子间可以形成氢键
B.Y元素的两种同素异形体常温下都是气体
C.阴离子半径从大到小的顺序为X>Y>Z>W
D.最高价氧化物对应的水化物的酸性:W>Z