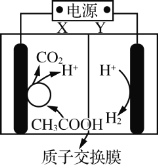
题目内容
【题目】有机物C常用于食品行业。已知9.0gC在足量O2中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4g和13.2g,经检验剩余气体为O2。
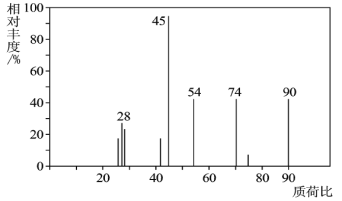
(1)C分子的质谱图如图所示,从图中可知其相对分子质量是__,则C的分子式是__。
(2)C能与NaHCO3溶液发生反应,C一定含有的官能团是__。
(3)C分子的核磁共振氢谱有4个峰,峰面积之比是1:1:1:3,则C的结构简式是__。
(4)0.1molC与1.0mol/L的氢氧化钠溶液反应,需溶液的体积是__mL。
【答案】90 C3H6O3 羧基(-COOH) CH3CH(OH)COOH 100 mL
【解析】
根据质谱仪的最大质荷比得相对分子质量,通过燃烧法确定实验式,最后可以确定结构简式;醇羟基没有酸性不能与氢氧化钠、碳酸钠、碳酸氢钠反应,可以与钠单质反应,羧基具有酸性,可以与钠、氢氧化钠、碳酸钠、碳酸氢钠反应。
(1)由质谱仪的最大质荷比可知C的相对分子质量为90,经过燃烧测定:0.1mol C在足量O2中充分燃烧,水的质量是5.4g,水的物质的量是0.3mol,氢元素物质的量为0.6mol;二氧化碳的质量13.2g,其物质的量为0.3mol,碳元素物质的量为0.3mol;9.0gC中含氧元素的质量=(9-0.6×1-0.3×12)g=4.8g,则氧元素的物质的量为0.3mol,n(C):n(H):n(O)=1:2:1,则实验式为CH2O,由于相对分子质量为90,则分子式为C3H6O3;
(2)根据分析,C能与NaHCO3溶液发生反应,C一定含有的官能团是羧基(-COOH);
(3)C分子的核磁共振氢谱有4个峰,峰面积之比是1:1:1:3,则分子有1个-CH3,1个-COOH,1个-OH,1个![]() ,则C的结构简式是CH3CH(OH)COOH;
,则C的结构简式是CH3CH(OH)COOH;
(4)C中的羟基不与氢氧化钠反应,羧基可以发生反应,故0.1molC会消耗0.1mol氢氧化钠反应,故所需氢氧化钠溶液的体积是![]() =0.1 L=100 mL。
=0.1 L=100 mL。

【题目】欲配制250mL0.1molL-1的稀盐酸,实验室的浓盐酸密度为1.25gcm-3,质量分数为36.5%。
请回答下列问题:
(1)配制稀盐酸时下表中不需要使用的仪器有___(填序号),还缺少的仪器为___、___(写仪器名称)。
序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
仪器 |
|
|
|
|
|
|
(2)需要量取浓盐酸的体积为___mL。
(3)配制该溶液的操作顺序是:D→___→___→___→___→B(用字母符号表示,每个字母符号只用一次)。
A.用30mL蒸馏水洗涤烧杯和玻璃棒各2~3次,将洗涤液全部注入容量瓶中并轻轻摇动
B.将容量瓶盖紧,振满,摇匀
C.将已恢复至室温的盐酸沿玻璃棒注入所选用的容量瓶中
D.用量筒准确量取所需体积的浓盐酸,将其沿玻璃棒注入烧杯中,再向烧杯中加入少量蒸馏水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
E.改用胶头滴管滴加蒸馏水,使溶液的凹液面恰好与容量瓶的刻度线相切
F.继续往容量瓶中小心地滴加蒸馏水,直到液面接近刻度线1~2cm处
(4)在定容时,液面高于刻度线,则所配溶液的浓度将___(选填“偏高”或“偏低”),该如何处理?___。