题目内容
【题目】利用所学化学反应原理,解决以下问题:
(1)一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如右图所示,请回答下列问题:
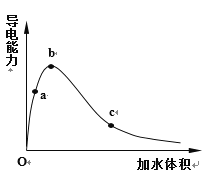
①写出冰醋酸电离方程式____________
②加水过程中,其水溶液导电能力变化的原因是:_______________________________________
③a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:__________(填“相同”、“a点大”、“b点大”、“c点大”)
(2)常温下,将0.2 mol·L-1的CH3COOH和0.1 mol·L-1的NaOH溶液等体积混合,所得溶液的pH=5(溶液体积变化忽略不计),则该溶液中:
c(CH3COO) + c(CH3COOH)= _______mol/L
c(H+) - c(CH3COO)+ c(Na+) = _______mol/L
(3)KAl(SO4)2·12H2O可做净水剂,其原理是____________________________________(用离子方程式表示)
(4)在0.10 mol·L-1 Na2SO3溶液中,离子浓度由大到小的顺序为___________________________________。
【答案】CH3COOH![]() CH3COO+H+ 冰醋酸中没有水,不能电离出自由移动的离子,所以导电性为零,当加水时冰醋酸电离,导电性增强,当达到b点时,水量越来越多,离子浓度下降,导电性又会下降 相同 0.1 109 Al3++3H2O
CH3COO+H+ 冰醋酸中没有水,不能电离出自由移动的离子,所以导电性为零,当加水时冰醋酸电离,导电性增强,当达到b点时,水量越来越多,离子浓度下降,导电性又会下降 相同 0.1 109 Al3++3H2O![]() Al(OH)3(胶体)+3H+ c(Na+)> c(SO32-) > c(OH)>c(HSO3-) >c(H+)
Al(OH)3(胶体)+3H+ c(Na+)> c(SO32-) > c(OH)>c(HSO3-) >c(H+)
【解析】
(1)溶液中电解质的导电能力与离子浓度有关,弱电解质加水稀释的过程中存在电离平衡的移动;
(2)盐类溶液中离子之间存在:物料守恒![]() 为等同于原醋酸溶液稀释之后浓度;电荷守恒,
为等同于原醋酸溶液稀释之后浓度;电荷守恒,![]() 源自
源自![]() ;
;
(3)KAl(SO4)2·12H2O中铝离子发生水解产生氢氧化铝胶体,具有吸附作用,可做净水剂;
(4)Na2SO3属于强碱弱酸盐,亚硫酸根离子水解显碱性。
(1) ①醋酸属于弱电解质,部分发生电离,离子方程式为:![]() ;
;
②冰醋酸中没有水,不能电离出自由移动的离子,所以导电性为零,当加水时冰醋酸电离,导电性增强,当达到b点时,水量越来越多,离子浓度下降,导电性又会下降;
③由于酸的物质的量未发生改变,所以酸碱中和中所需的碱的物质的量相同;
(2)由物质的量守恒可知![]() =0.1mol/L.
=0.1mol/L. ![]() =
=![]() = 109;
= 109;
(3)KAl(SO4)2·12H2O中铝离子发生水解产生氢氧化铝胶体,具有吸附作用,可做净水剂,离子方程式为:![]() ;
;
(4)Na2SO3属于强碱弱酸盐,亚硫酸根离子水解显碱性,溶液中离子浓度大小关系为:![]() ;
;

【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
(实验原理)2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
(实验内容及记录)
实验编号 | 实验温度 | 试管中所加试剂及其用量/mL | 溶液褪至无色所需时间/min | |||
0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | |||
① | 25 | 3.0 | V1 | 2.0 | 3.0 | 1.5 |
② | 25 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
③ | 50 | 2.0 | V2 | 2.0 | 3.0 | 1.0 |
(1)请完成此实验设计,其中:V1=_________,V2=___________。
(2)根据上表中实验①、②的数据,可以得到的结论是_________________________________。
(3)探究温度对化学反应速率的影响,应选择__________(填实验编号)。
(4)该小组同学根据经验绘制了n(Mn2+)随时间变化的趋势如图1所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的实际趋势如图2所示。
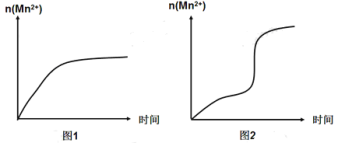
该小组同学根据图2所示信息提出了新的假设,并设计以下实验方案继续进行实验探究。
实验编号 | 实验温度/℃ | 试管中所加试剂及其用量 | 再向试管中加入某种固体 | 溶液褪至无色所需时间/min | |||
0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | ||||
④ | 25 | 2.0 | 3.0 | 2.0 | 3.0 | MnSO4 | t |
该小组同学提出的假设是___________________________________________。