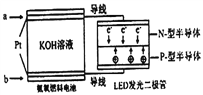
题目内容
【题目】二氯化砜(SO2Cl2)是一种重要的有机合成试剂,实验室可利用SO2与Cl2反应制取少量的SO2Cl2。装置如图(有些支持装置省略了)所示。
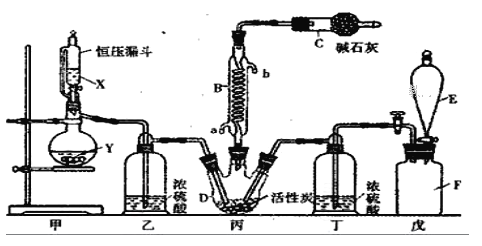
已知SO2Cl2的熔点为-54.1℃,沸点为69. 1℃;常温下比较稳定,受热易分解,遇水能发生剧烈的水解反应,产物之一为氯化氢气体。
(1)戊是贮气装置, F瓶中的气体能使湿润的有色布条褪色,则F瓶中的气体的实验室制法是________________________________(用方程式表示);
(2)B处反应管冷却水应从__________(填“a”或“b”)接口通入;C仪器的名称为____________,碱石灰的作用为____________。
(3)装置乙和丁的作用是____________;
(4)恒压漏斗具有特殊的结构,主要目的是___________;
(5)写出二氯化砜(SO2Cl2)水解反应的方程式________________;
(6)SO2溶于水生成亚硫酸,亚硫酸的酸性强于次氯酸,选用下面的装置和药品探究亚硫酸与次氯酸的酸性强弱:

装置连接顺序为A、_______、______、______、D、F,其中E的作用是____________,通过________________现象即可证明亚硫酸的酸性强于次氯酸。
【答案】 MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O或2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O a 干燥管 防止空气中的水蒸气进入丙装置使SO2Cl2发生水解,并且吸收反应剩余的有毒气体、防止污染空气 干燥SO2和 Cl2,防止SO2Cl2发生水解反应 使所加的液体能顺利滴入烧瓶中 SO2Cl2+H2O=H2SO4+2HCl C B E 除去SO2气体 当D中品红不褪色,F中漂白粉溶液变浑浊
MnCl2+Cl2↑+2H2O或2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O a 干燥管 防止空气中的水蒸气进入丙装置使SO2Cl2发生水解,并且吸收反应剩余的有毒气体、防止污染空气 干燥SO2和 Cl2,防止SO2Cl2发生水解反应 使所加的液体能顺利滴入烧瓶中 SO2Cl2+H2O=H2SO4+2HCl C B E 除去SO2气体 当D中品红不褪色,F中漂白粉溶液变浑浊
【解析】试题分析:由题意知,甲为制备二氧化硫的装置,乙为干燥二氧化硫的装置,戊为氯气的储气瓶、丁为氯气的干燥装置、丙为SO2Cl2的制备装置。
(1)戊是贮气装置, F瓶中的气体能使湿润的有色布条褪色,则该气体为氯气,其实验室制法是MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O或2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O ;
MnCl2+Cl2↑+2H2O或2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O ;
(2)B处反应管冷却水应从a接口通入;C仪器的名称为干燥管,其中碱石灰的作用为:防止空气中的水蒸气进入丙装置使SO2Cl2发生水解,并且吸收反应剩余的有毒气体、防止污染空气。
(3)装置乙和丁的作用是干燥SO2和 Cl2,防止SO2Cl2发生水解反应;
(4)恒压漏斗具有特殊的结构,主要目的是使所加的液体能顺利滴入烧瓶中;
(5)二氯化砜(SO2Cl2)水解反应的方程式为SO2Cl2+H2O=H2SO4+2HCl;
(6)由图中信息可知,A为二氧化硫的发生装置,C装置用于除去二氧化硫中的HCl杂质,B为二氧化碳的发生装置、且证明亚硫酸的酸性比碳酸强,E是除去剩余二氧化硫的装置,D是检验二氧化硫已除尽的装置,F是证明碳酸的酸性比次氯酸强的装置。因此,装置连接顺序为A、C、B、E、D、F,其中E的作用是除去SO2气体,通过当D中品红不褪色、F中漂白粉溶液变浑浊的现象即可证明亚硫酸的酸性强于次氯酸。

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案【题目】CO、NO2等有毒气体的转化以及氮的化合物合成、应用及氮的固定一直是科学研究的热点。
(1)以CO2与NH3为原料合成化肥尿素[CO(NH2)2]的主要反应如下:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) △H= -159.47kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) △H=akJ·mol-1
③2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g) △H= -86.98kJ·mol-1
则a=_______。
(2)反应2NH3(g)+CO2(g)![]() CO(NH2)2(1)+H2O(g),在合成塔中进行。右图中I、II、III三条曲线为合成塔中按不同氨碳比和水碳比投料时二氧化碳转化率的情况。曲线I、II、III水碳比的数值分别为:
CO(NH2)2(1)+H2O(g),在合成塔中进行。右图中I、II、III三条曲线为合成塔中按不同氨碳比和水碳比投料时二氧化碳转化率的情况。曲线I、II、III水碳比的数值分别为:
I.0.6~0.7 II.1~1.1 III.1.5~1.61
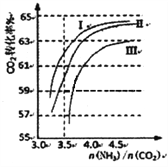
生产中应选用水碳比的数值为__________(选填序号)。
(3)4CO(g)+2NO2(g) ![]() 4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1 ,对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是_____(填代号)。
4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1 ,对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是_____(填代号)。
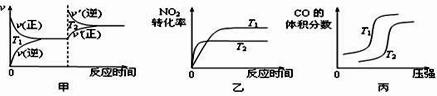
(4)用活性炭还原法也可以处理氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g) ![]() N2(g)+CO2(g) ΔH在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
N2(g)+CO2(g) ΔH在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
浓度/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①30min后,只改变某一条件,根据上表的数据判断改变的条件可能是_______(填字母代号)。
a.加入一定量的活性炭 b.通入一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂
②若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则达到新平衡时NO的转化率_________(填“升高”或“降低”),ΔH___________0(填“>”或“<”).
(5)一种氨燃料电池,使用的电解质溶液是2mol/L的KOH溶液。电池反应为:4NH3+3O2=2N2+6H2O;请写出通入a气体一极的电极反应式为____________________