题目内容
【题目】CO、NO2等有毒气体的转化以及氮的化合物合成、应用及氮的固定一直是科学研究的热点。
(1)以CO2与NH3为原料合成化肥尿素[CO(NH2)2]的主要反应如下:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) △H= -159.47kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) △H=akJ·mol-1
③2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g) △H= -86.98kJ·mol-1
则a=_______。
(2)反应2NH3(g)+CO2(g)![]() CO(NH2)2(1)+H2O(g),在合成塔中进行。右图中I、II、III三条曲线为合成塔中按不同氨碳比和水碳比投料时二氧化碳转化率的情况。曲线I、II、III水碳比的数值分别为:
CO(NH2)2(1)+H2O(g),在合成塔中进行。右图中I、II、III三条曲线为合成塔中按不同氨碳比和水碳比投料时二氧化碳转化率的情况。曲线I、II、III水碳比的数值分别为:
I.0.6~0.7 II.1~1.1 III.1.5~1.61
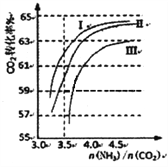
生产中应选用水碳比的数值为__________(选填序号)。
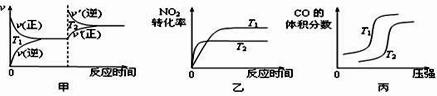
(3)4CO(g)+2NO2(g) ![]() 4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1 ,对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是_____(填代号)。
4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1 ,对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是_____(填代号)。
(4)用活性炭还原法也可以处理氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g) ![]() N2(g)+CO2(g) ΔH在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
N2(g)+CO2(g) ΔH在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
浓度/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①30min后,只改变某一条件,根据上表的数据判断改变的条件可能是_______(填字母代号)。
a.加入一定量的活性炭 b.通入一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂
②若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则达到新平衡时NO的转化率_________(填“升高”或“降低”),ΔH___________0(填“>”或“<”).
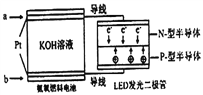
(5)一种氨燃料电池,使用的电解质溶液是2mol/L的KOH溶液。电池反应为:4NH3+3O2=2N2+6H2O;请写出通入a气体一极的电极反应式为____________________
【答案】 +72.49 I 乙 bc 降低 < 2NH3+6OH-– 6e-=N2 + 6H2O
【解析】(1)以CO2与NH3为原料合成化肥尿素[CO(NH2)2]的主要反应如下:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) △H= -159.47kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) △H=akJ·mol-1
③2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g) △H= -86.98kJ·mol-1
根据盖斯定律得:③-①=②,则a=-86.98kJ·mol-1-(-159.47kJ·mol-1)=+72.49 kJ·mol-1,故答案为:+72.49;
(2).由图可知,氨碳比相同时曲线Ⅰ对应的二氧化碳的转化率大,所以生产中选用水碳比的数值为I,故答案为:I;
(3).甲图:升高温度时,化学平衡逆向移动,正逆反应速率都加快,所以反应速率会离开原来的速率点,故甲图错误;乙图:升高温度,反应速率加快,达到平衡所需的时间变短,所以温度为T2时先达到平衡状态,又因升高温度平衡逆向移动,NO2的转化率减小,所以温度为T2时NO2的转化率小,故乙图正确;丙图:对于反应4CO(g)+2NO2(g) ![]() 4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1 ,温度相同时,增大压强,平衡正向移动,CO的体积分数减小,故丙图错误;答案选:乙;
4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1 ,温度相同时,增大压强,平衡正向移动,CO的体积分数减小,故丙图错误;答案选:乙;
(4). ①.30min后,只改变某一条件,反应重新达到平衡时,由表中数据可知,NO、N2、CO2的浓度都增大,a.活性炭是固体,加入一定量的活性炭,对平衡无影响,故a不符合;b. 通入一定量的NO,平衡正向移动,达到新的平衡后,NO、N2、CO2的浓度都增大,故b符合;c.因该反应是反应前后气体体积不变的可逆反应,适当缩小容器的体积,平衡不移动,但各物质的浓度增大,故c符合;d.加入合适的催化剂,不能使平衡移动,各物质的浓度不变,故d不符合;答案选bc;
②.30min时,容器中NO、N2、CO2的浓度之比为:0.4:0.3:0.3=4:3:3,30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,说明平衡向逆反应方向移动,所以NO的转化率降低,逆反应是吸热反应,正反应为放热反应,△H<0,故答案为:降低;<;
(5). 该氨燃料电池,使用的电解质溶液是2mol/L的KOH溶液,电池反应为:4NH3+3O2=2N2+6H2O,由图中e-转移的方向可知,通入a气体的电极为负极,在该反应中,氮元素的化合价从-3价升高到0价,则氨气在负极失去电子生成氮气,负极的电极反应式为:2NH3+6OH-– 6e-=N2 + 6H2O,故答案为:2NH3+6OH-– 6e-=N2 + 6H2O。

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案【题目】类推思维是化学解题中常用的一种思维方法,下列有关离子方程式的类推正确的是( )
已知 | 类推 | |
A | 将Fe加入CuSO4溶液中:Fe+Cu2+=Cu+Fe2+ | 将Na加入到CuSO4溶液中:2Na+Cu2+=Cu+2Na+ |
B | 向Ca(ClO)2溶液中通入少量CO2 Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
C | 用惰性电极电解NaCl溶液:2Cl-+2H2O | 用惰性电极电解MgBr2溶液:2Br-+2H2O |
D | 稀盐酸与NaOH溶液反应至中性:H++OH-=H2O | 稀HNO3与Ba(OH)2溶液反应至中性:H++OH-=H2O |
A. A B. B C. C D. D