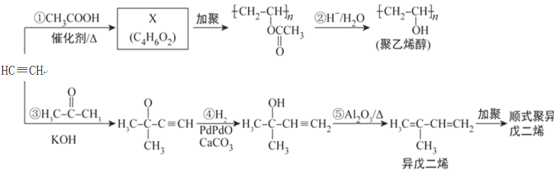
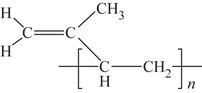
题目内容
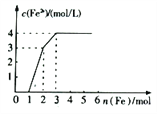
【题目】某稀溶被中含有Fe(NO3)3、Cu(NO3)2、HNO3,若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如图所示,则稀溶液中Fe(NO3)3、Cu(NO3)2、HNO3的物质的量浓度之比为
A. 1:1:1 B. 1:3:1 C. 3:3:8 D. 1:1:4
【答案】D
【解析】稀溶液中各物质的氧化性顺序为HNO3>Fe(NO3)3>Cu(NO3)2,加入铁后会依次发生氧化还原反应,①Fe+4HNO3=Fe(NO3)3+NO↑+2H2O;②Fe+2Fe3+=3Fe2+;③Fe+Cu2+=Cu+Fe2+;从图象中可知铁为1mol时,无Fe2+生成,发生的反应是①消耗硝酸为4mol,生成Fe3+1mol;再加入1mol铁发生反应②生成Fe2+物质的量为3mol,反应的Fe3+物质的量为2mol,其中原溶液中的Fe3+物质的量2mol-1mol=1mol;再加入1mol铁发生反应③,此时又生成Fe2+物质的量为1mol,说明原溶液中Cu2+物质的量为1mol;综上所述可知原溶液中Fe(NO3)3为1mol,Cu(NO3)2物质的量为1mol,HNO3物质的量为4mol,稀溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为1:1:4;答案选D。

练习册系列答案
相关题目