题目内容
【题目】(1)在MnO2+4HCl![]() MnCl2+2H2O+Cl2↑反应中。
MnCl2+2H2O+Cl2↑反应中。
①__元素被氧化,__是氧化剂。
②__是氧化产物,__发生氧化反应。
③用“双线桥”法标明电子转移的方向和数目__。
④参加反应的氯化氢和被氧化的氯化氢的物质的量之比__。
(2)现有mg某气体,它是三原子分子,其摩尔质量为Mg·mol-1。若阿伏加德罗常数用NA表示,请用以上符号及相应数字填写下列空格。
①该气体的物质的量为__mol。
②该气体所含原子总数为___个。
③该气体在标准状况下的体积为__L。
④该气体完全溶于水形成VL溶液(不考虑反应),所得溶液的物质的量浓度__mol·L-1。
【答案】Cl MnO2 Cl2 HCl 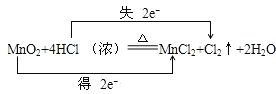 2∶1
2∶1 ![]()
![]()
![]()
![]()
![]()
【解析】
(1)MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O中,Mn元素的化合价降低,Cl的元素的化合价升高,结合氧化还原反应的规律分析解答;
MnCl2+Cl2↑+2H2O中,Mn元素的化合价降低,Cl的元素的化合价升高,结合氧化还原反应的规律分析解答;
(2)①据n=![]() 计算;②根据每个分子中含有的原子数计算总原子数;③根据V=nVm计算;④根据c=
计算;②根据每个分子中含有的原子数计算总原子数;③根据V=nVm计算;④根据c=![]() 计算。
计算。
(1)MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O的反应中Cl元素的化合价升高,HCl为还原剂,在反应中被氧化,发生氧化反应,氧化产物为Cl2,Mn元素的化合价降低,MnO2为氧化剂, 发生还原反应。
MnCl2+Cl2↑+2H2O的反应中Cl元素的化合价升高,HCl为还原剂,在反应中被氧化,发生氧化反应,氧化产物为Cl2,Mn元素的化合价降低,MnO2为氧化剂, 发生还原反应。
①Cl元素被氧化,MnO2是氧化剂,故答案为:Cl;MnO2;
②Cl2是氧化产物,HCl发生氧化反应,故答案为:Cl2;HCl;
③在MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O的反应中,锰元素化合价降低,氯元素化合价升高,转移电子数为2mol,用“双线桥法”表示氧化还原反应中电子转移情况为:
MnCl2+Cl2↑+2H2O的反应中,锰元素化合价降低,氯元素化合价升高,转移电子数为2mol,用“双线桥法”表示氧化还原反应中电子转移情况为: ,故答案为:
,故答案为: ;
;
④由反应可知,4molHCl参加反应,其中2mol作还原剂被氧化,则参加反应的HCl与被氧化的HCl的物质的量之比为2∶1,故答案为:2∶1;
(2)①m g某气体的物质的量为![]() =
=![]() mol,故答案为:
mol,故答案为:![]() ;
;
②因为一个分子中含三个原子,所以含有的原子数为分子数的3倍,即为3×![]() mol×NAmol-1=
mol×NAmol-1=![]() NA,故答案为:
NA,故答案为:![]() NA;
NA;
③标准状况下,该气体的体积为![]() mol×22.4L/mol=
mol×22.4L/mol=![]() L,故答案为:
L,故答案为:![]() ;
;
④所得溶液的物质的量浓度=![]() mol/L=
mol/L=![]() mol/L,故答案为:
mol/L,故答案为:![]() 。
。





