题目内容
【题目】在25℃、101kPa的条件下,断裂1molH—H键吸收436kJ能量,断裂1molCl—Cl键吸收243kJ能量,形成1molH—Cl键放出431kJ能量。该条件下H2+Cl2![]() 2HCl反应中的能量变化可用如图表示:
2HCl反应中的能量变化可用如图表示:

现有1molH2和1molCl2在25℃、101kPa下完全反应。请根据上述信息回答下列有关问题:
(1)反应物断键吸收的总能量为___。
(2)生成物成键放出的总能量为___。
(3)H2+Cl2![]() 2HCl是___(填“吸热”或“放热”)反应。
2HCl是___(填“吸热”或“放热”)反应。
(4)反应物的总能量___(填“>”或“<”)生成物的总能量。
(5)写出盐酸与氢氧化铝反应的离子方程式__。
【答案】679kJ 862kJ 放热 > Al(OH)3+3H+=Al3++3H2O
【解析】
反应物断键吸收能量,生成物成键放出能量,二者能量的差值为反应的热效应,根据△H的大小判断反应的吸放热类型。
(1)反应物断键吸收的总能量为氢气和氯气的键能和,则反应物断键吸收的总能量为436+243=679kJ;
答案为:679kJ;
(2)生成物成键放出的总能量为2molHCl的总键能,则生成物成键放出的总能量为431×2=862kJ;
答案为862kJ;
(3)反应热=反应物的键能减生成物的键能=436kJmol-1+243kJmol-1-2×431 kJmol-1=-183kJmol-1,△H<0,所以该反应为放热反应;
答案为:放热;
(4)由(3)可知△H<0,该反应为放热反应,所以反应物的总能量>生成物的总能量;答案为:>;
(5)盐酸与氢氧化铝反应的离子方程式:Al(OH)3+3H+=Al3++3H2O;
答案为:Al(OH)3+3H+=Al3++3H2O。

 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案【题目】I.用活性炭还原处理氮氧化物,有关反应为C(s)+2NO(g)![]() N2(g)+CO2(g)。在2L恒容密闭容器中加入足量C与NO发生反应,所得数据如表,回答下列问题。
N2(g)+CO2(g)。在2L恒容密闭容器中加入足量C与NO发生反应,所得数据如表,回答下列问题。
实验编号 | 温度/℃ | 起始时NO的物质的量/mol | 平衡时N2的物质的量/mol |
1 | 700 | 0.40 | 0.09 |
2 | 800 | 0.24 | 0.08 |
(1)写出上述反应的平衡常数表达式______。
(2)①结合表中数据,判断该反应的ΔH____0(填“>”或“<”),理由是_____
②判断该反应达到平衡的依据是_____。
A.容器内气体密度恒定 B.容器内各气体浓度恒定
C.容器内压强恒定 D.2v正(NO)=v逆(N2)
II.结合下表回答下列问题(均为常温下的数据):
酸 | 电离常数(Ka) |
CH3COOH | 1.8×10-5 |
HClO | 3×10-8 |
H2CO3 | K1=4.4×10-7 K2=4.7×10-11 |
H2C2O4 | K1=5.4×10-2 K2=5.4×10-5 |
| <>H2S | K1=1.3×10-7 K2=7.1×10-15 |
请回答下列问题:
(1)同浓度的CH3COO-、![]() 、
、![]() 、
、![]() 、ClO-、S2-中结合H+的能力最弱的是____。
、ClO-、S2-中结合H+的能力最弱的是____。
(2)常温下0.1mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是___(填字母)。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)/c(OH-) D.c(OH-)
(3)0.1mol·L-1的H2C2O4溶液与0.1mol·L-1的KOH的溶液等体积混合后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为_____。
(4)pH相同的NaClO和CH3COOK溶液,其溶液的物质的量浓度的大小关系是CH3COOK___NaClO,两溶液中:c(Na+)-c(ClO-)___c(K+)-c(CH3COO-)(填“>”“<”或“=”)。
(5)向0.1mol·L-1CH3COOH溶液中滴加NaOH溶液至c(CH3COOH)∶c(CH3COO-)=5∶9,此时溶液pH=____。
【题目】用图所示装置检验乙烯时不需要除杂的是
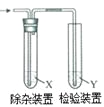
乙烯的制备 | 试剂X | 试剂Y | |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
C | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
D | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | Br2的CCl4溶液 |
【题目】Ⅰ.控制变量法是化学实验的一种常用方法。下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:
序号 | 硫酸的体积/mL | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
1 | 50.0 | 2.0 | 薄片 | 25 | 100 |
|
2 | 50.0 | 2.0 | 颗粒 | 25 | 70 |
|
3 | 50.0 | 2.0 | 颗粒 | 35 | 35 |
|
4 | 50.0 | 2.0 | 粉末 | 25 | 45 | 5.0 |
5 | 50.0 | 6.0 | 粉末 | 35 | 30 |
|
(1)本实验中实验2和实验3表明______________________________对反应速率有影响。
(2)若采用与实验1完全相同的条件,但向反应容器中滴加少量硫酸铜溶液,发现反应速率明显加快。原因是________________________________________________。
Ⅱ.某温度时,在5L的容器中,X、Y、Z 三种气体的物质的量随时间的变化曲线如图所示。请通过计算回答下列问题:
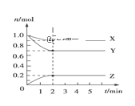
(3)反应开始至2 min,Y的平均反应速率_______mol·L-1min-1 。
(4)反应开始至2 min,X的转化率________。
(5)写出 X、Y、Z 的反应方程式__________________________________________。