题目内容
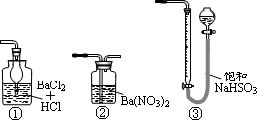
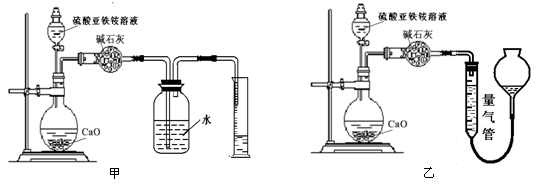
(15分)Ⅰ.某实验小组把CO2通入饱和Na2CO3溶液制取NaHCO3,装置如图所示(气密性已检验,部分夹持装置略):
(1)请结合化学平衡移动原理解释B中溶液的作用 。
(2)当D中有大量白色固体析出时,停止实验,将固体过滤、洗涤,取一定量配成样液,并加入BaCl2溶液,出现白色沉淀并有气体产生,其离子方程是 。
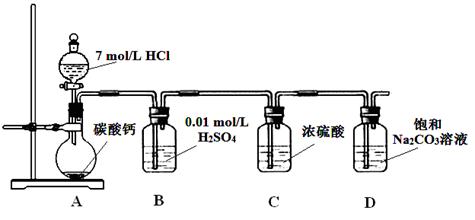
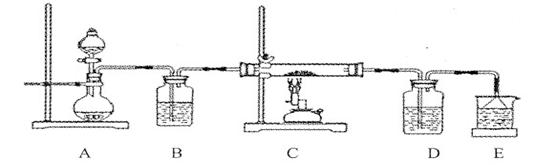
Ⅱ.某课外活动小组欲利用氨气与CuO反应,研究氨气的性质并测其组成,设计了如下实验(夹持装置未画出)进行实验。请回答下列问题:

(1)仪器b中可选择的试剂为(任意填一种)_____________。
(2)实验中,装置C中黑色CuO粉末全部转化为红色固体(已知Cu2O也为红色固体),量气管中有无色无味的气体。实验前称取黑色CuO 80g,实验后得到红色固体质量为68g。则红色固体成分的化学式为_______________。
(3)F中读取气体体积前,应向上或向下移动右管,使得左右两边液面相平,若无此操作,而F中左边液面低于右边液面,会导致读取的气体体积________ (填“偏大”或“偏小”或“无影响”)。
(4)要想测得氨气分子中氮、氢原子个数比,实验中应至少测量或读取哪些数据________(填序号)。
a.B装置实验前后质量差mg; b.F装置实验前后液面差VL
c.D装置实验前后质量差mg; d.E装置实验前后质量差mg;
(5)E装置中浓硫酸的作用是__________________________________________。

(1)请结合化学平衡移动原理解释B中溶液的作用 。
(2)当D中有大量白色固体析出时,停止实验,将固体过滤、洗涤,取一定量配成样液,并加入BaCl2溶液,出现白色沉淀并有气体产生,其离子方程是 。
Ⅱ.某课外活动小组欲利用氨气与CuO反应,研究氨气的性质并测其组成,设计了如下实验(夹持装置未画出)进行实验。请回答下列问题:

(1)仪器b中可选择的试剂为(任意填一种)_____________。
(2)实验中,装置C中黑色CuO粉末全部转化为红色固体(已知Cu2O也为红色固体),量气管中有无色无味的气体。实验前称取黑色CuO 80g,实验后得到红色固体质量为68g。则红色固体成分的化学式为_______________。
(3)F中读取气体体积前,应向上或向下移动右管,使得左右两边液面相平,若无此操作,而F中左边液面低于右边液面,会导致读取的气体体积________ (填“偏大”或“偏小”或“无影响”)。
(4)要想测得氨气分子中氮、氢原子个数比,实验中应至少测量或读取哪些数据________(填序号)。
a.B装置实验前后质量差mg; b.F装置实验前后液面差VL
c.D装置实验前后质量差mg; d.E装置实验前后质量差mg;
(5)E装置中浓硫酸的作用是__________________________________________。
Ⅰ.(1)CO2在水中存在平衡:CO2+H2O H2CO3
H2CO3 HCO3-+H+,有H2SO4存在时,可使上述平衡向左移动,从而减少CO2在水中的溶解,同时吸收挥发出来的HCl气体
HCO3-+H+,有H2SO4存在时,可使上述平衡向左移动,从而减少CO2在水中的溶解,同时吸收挥发出来的HCl气体
(2)2HCO3-+Ba2+=BaCO3↓+ CO2↑+H2O
Ⅱ.(1)碱石灰或生石灰或氢氧化钠固体(
(2)Cu和Cu2O (3)偏小 (4)b、c
(5)防止F中水蒸气进入D中,并吸收氨气
 H2CO3
H2CO3 HCO3-+H+,有H2SO4存在时,可使上述平衡向左移动,从而减少CO2在水中的溶解,同时吸收挥发出来的HCl气体
HCO3-+H+,有H2SO4存在时,可使上述平衡向左移动,从而减少CO2在水中的溶解,同时吸收挥发出来的HCl气体(2)2HCO3-+Ba2+=BaCO3↓+ CO2↑+H2O
Ⅱ.(1)碱石灰或生石灰或氢氧化钠固体(
(2)Cu和Cu2O (3)偏小 (4)b、c
(5)防止F中水蒸气进入D中,并吸收氨气
试题分析:I、(1)由图可知,A中生成二氧化碳,在D中二氧化碳与碳酸钠、水反应生成碳酸氢钠,B中酸可抑制二氧化碳的溶解,则B中溶液的作用为CO2在水中存在平衡:CO2+H2O?H2CO3?HCO3-+H+,有H2SO4存在时,可使上述平衡向左移动,从而减少CO2在水中的溶解,同时吸收挥发出来的HCl气体;(2)D中的大量白色固体为NaHCO3,加入BaCl2溶液,出现白色沉淀为BaCO3,气体应为CO2,反应方程式为:2HCO3-+Ba2+=BaCO3↓+ CO2↑+H2O。
II、(1)依据装置仪器可知,浓氨水滴入锥形瓶中利用固体溶解放热使一水合氨分解生成氨气,需要选择氢氧化钠固体,氧化钙固体或碱石灰;(2)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,实验前称取黑色CuO 80g,物质的量为1mol,依据铜元素守恒,结合红色物质可能为铜或氧化亚铜,若为铜质量为64g,若为氧化亚铜质量=0.5mol×144g/mol=72g,实验后得到红色固体质量为68g.则红色固体成分的化学式为Cu和Cu2O;(3)读取气体体积前,应对装置F进行的操作是慢慢上下移动右边漏斗,使左右两管液面相平,保持压强平衡再读数;若无此操作,而F中左边液面低于右边液面,会导致读取的气体体积偏小;(4)若测得干燥管D增重为水物质的量,装置F测得气体的体积为为N2,计算得到气体物质的量,依据元素守恒得到氮原子和氢原子物质的量之比,所以选择bc;(5)依据流程分析,浓硫酸是吸收过量的氨气,阻止F中水蒸气进入D影响实验效果。

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目



 CuCl42-(黄色)+4H2O。
CuCl42-(黄色)+4H2O。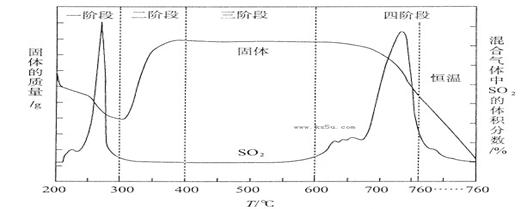





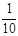 置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,消耗标准溶液20.00ml。请回答下列问题:
置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,消耗标准溶液20.00ml。请回答下列问题: