题目内容
5.下列各组顺序的排列不正确的是( )| A. | 金属性:Na<Mg<Al | B. | 热稳定性:HCl>H2S>PH3 | ||
| C. | 酸性强弱:H2SiO3<H2CO3<HNO3 | D. | 碱性:Ba(OH)2>Ca(OH)2>Mg(OH)2 |
分析 A、同周期从左到右金属性减弱;
B、中心元素非金属性越强,对应的氢化物越稳定;
C、非金属性越强,对应最高价氧化物的水化物的酸性越强;
D、金属性越强,对应最高价氧化物的水化物的碱性越强.
解答 解:A、Na、Mg、Al位于同周期,从左到右金属性减弱,所以金属性:Na>Mg>Al,故A错误;
B、非金属性:Cl>S>P,所以氢化物越稳定为:HCl>H2S>PH3,故B正确;
C、非金属性Si<C<N,所以对应最高价氧化物的水化物的酸性越强弱为:H2SiO3<H2CO3<HNO3,故C正确;
D、金属性Ba>Ca>Mg,对应最高价氧化物的水化物的碱性为Ba(OH)2>Ca(OH)2>Mg(OH)2,故D正确;
故选A.
点评 本题考查金属性和非金属性,明确物质的酸性、气态氢化物的稳定性,碱性与非金属性、金属性的关系是解答本题的关键,难度不大.

练习册系列答案
相关题目
17.下列生产过程中,不涉及氧化还原反应的是( )
| A. | 氯碱工业 | B. | 制普通玻璃 | C. | 海水提溴 | D. | 工业制硝酸 |
18.“化学--我们的生活,我们的未来”.下列有关知识叙述正确的是( )
| A. | 氢气是未来的理想燃料 | B. | 苯酚不能用于杀菌消毒 | ||
| C. | 人体缺铁易引起甲状腺肿大 | D. | 乙醇是不可再生的生物质能源 |
13.下列排列顺序正确的是( )
| A. | 粒子半径:Al3+>Mg2+>Na+ | B. | 热稳定性:HI>HBr>HCl>HF | ||
| C. | 酸性:H2CO3<H2SO4<HClO4 | D. | 碱性:Al(OH)3>Mg(OH) 2>NaOH |
20.下列图示实验正确的是( )
| A. | 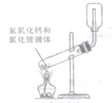 实验室制备氨气 | B. | 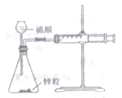 测量锌和硫酸反应的速率 | ||
| C. |  铁的吸氧腐蚀 | D. | 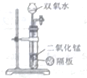 实验室制氧气 |
10.某同学设计了由乙醇合成乙二醇的路线如下.下列说法正确的是( )
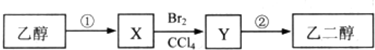

| A. | 等物质的量的乙醇、X完全燃烧,消耗氧气的量不相同 | |
| B. | 步骤②需要在氢氧化钠醇溶液中反应 | |
| C. | 步骤①的反应类型是水解反应 | |
| D. | X可以发生加成反应 |
17.下列反应中,属于消去反应的是( )
| A. | CH3CH=CH2+Br2$\stackrel{CCI_{4}}{→}$CH3CHBrCH2Br | |
| B. | CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$CH2=CH2+H2O | |
| C. | CH3CH2OH+Na→CH3CH2ONa+H2↑ | |
| D. | C6H6+HNO3$→_{△}^{浓H_{2}SO_{4}}$C6H5NO2+H2O |
14.在一密闭容器中充入一种气态烃和足量的氧气,用电火花点燃完全燃烧后,容器内气体体积保持不变,若气体体积均在120℃和相同的压强下测定的,这种气态烃可能是( )
| A. | C3H8 | B. | C3H4 | C. | C2H2 | D. | C3H6 |
15.下列反应中,属于取代反应的是( )
| A. | CH4$\stackrel{高温}{→}$C+2H2 | |
| B. | CH3CH=CH2+Br2$\stackrel{CCl_{4}}{→}$CH3CHBrCH2Br | |
| C. | CH+2O2$\stackrel{点燃}{→}$CO2+2H2O | |
| D. | CH4+Cl2$\stackrel{光}{→}$CH3Cl+HCl |