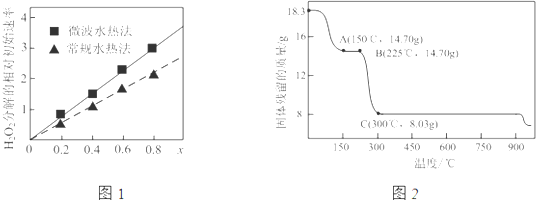
题目内容
17.下列生产过程中,不涉及氧化还原反应的是( )| A. | 氯碱工业 | B. | 制普通玻璃 | C. | 海水提溴 | D. | 工业制硝酸 |
分析 判断物质发生反应时,所含元素的化合价是否发生变化,如化合价发生变化,则发生氧化还原反应.
解答 解:A.氯碱工业生成Cl2、H2,存在化合价的变化,为氧化还原反应,故A不选;
B.玻璃工业的反应类型主要是复分解反应,不涉及氧化还原反应,故B选;
C.海水中溴存在于化合物中,海水提溴时,溴元素化合价升高,发生氧化还原反应,故C不选;
D.硝酸工业存在N2+3H2 2NH3、2NO+O2=2NO2、3NO2+H2O=2HNO3+NO,这几个反应都有电子的转移,所以涉及氧化还原反应,故D不选.
2NH3、2NO+O2=2NO2、3NO2+H2O=2HNO3+NO,这几个反应都有电子的转移,所以涉及氧化还原反应,故D不选.
故选B.
点评 本题考查氧化还原反应,题目难度不大,本题注意常见工业生产原理,注重基础知识的积累.

练习册系列答案
相关题目
7.已知金属单质X、Y、Z、W之间有下列关系
①2X+3Y2+=2X3++3Y;
②Z元素最高价氧化物对应的氢氧化物的碱性比X元素的强;
③由Y、W与稀硫酸组成的原电池,Y为负极.
则X、Y、Z、W的还原性由强到弱的顺序为( )
①2X+3Y2+=2X3++3Y;
②Z元素最高价氧化物对应的氢氧化物的碱性比X元素的强;
③由Y、W与稀硫酸组成的原电池,Y为负极.
则X、Y、Z、W的还原性由强到弱的顺序为( )
| A. | X>Z>Y>W | B. | Z>W>X>Y | C. | Z>Y>X>W | D. | Z>X>Y>W |
8.短周期元素X、Y、Z、W、Q在元素周期表中的位置如表所示,其中Q元素的原子的K、M层的电子数之和等于L层的电子数,则下列说法正确的是( )
| Y | W | ||
| X | Z | Q |
| A. | X的氧化物是红宝石、蓝宝石的主要成分 | |
| B. | Q的最高价氧化物的水化物的浓溶液中只存在一种分子 | |
| C. | W的氧化物有多种,其中只有+2价的氧化物有毒,对人体有危害 | |
| D. | Z的单质可由Z的氧化物与Y的单质反应制得,说明单质Y还原性强于单质Z |
5. 通过CO2电解固定技术有望减小室温效应并可得到多种燃料,其原因如图所示.下列说法中不正确的是( )
通过CO2电解固定技术有望减小室温效应并可得到多种燃料,其原因如图所示.下列说法中不正确的是( )
 通过CO2电解固定技术有望减小室温效应并可得到多种燃料,其原因如图所示.下列说法中不正确的是( )
通过CO2电解固定技术有望减小室温效应并可得到多种燃料,其原因如图所示.下列说法中不正确的是( )| A. | 阴极区溶液pH减小 | |
| B. | 当有6.72LO2(标况下)产生时转移的电子数为1.2mol | |
| C. | 电解时,生成乙烯的电极反应式是:2CO2+12e-+12H+=C2H4+4H2O | |
| D. | 该技术中能量转化方式主要有太阳能转化为电极及电能转化为化学能 |
12.下列说法正确的是( )
| A. | 淀粉、油脂和蛋白质都是高分子化合物 | |
| B. | 丁烷(C4H10)和二氯甲烷都存在同分异构体 | |
| C. | “地沟油”的主要成分是油脂,其类别与煤油不同 | |
| D. | 煤中含有煤焦油及多种化工原料,可通过煤的干馏获得 |
2.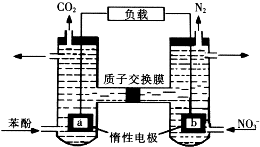 我国科学家构建了一种双室微生物燃料电池,以苯酚(C6H6O)为燃料,同时消除酸性废水中的硝酸盐.下列说法正确的是
我国科学家构建了一种双室微生物燃料电池,以苯酚(C6H6O)为燃料,同时消除酸性废水中的硝酸盐.下列说法正确的是
( )
 我国科学家构建了一种双室微生物燃料电池,以苯酚(C6H6O)为燃料,同时消除酸性废水中的硝酸盐.下列说法正确的是
我国科学家构建了一种双室微生物燃料电池,以苯酚(C6H6O)为燃料,同时消除酸性废水中的硝酸盐.下列说法正确的是( )
| A. | a为正极 | |
| B. | 左池电极反应式为C6H6O+11H2O-28e-=6CO2↑+28H+ | |
| C. | 若右池产生0.672L气体(标况下),则转移电子0.15mol | |
| D. | 左池消耗的苯酚与右池消耗的NO${\;}_{3}^{-}$的物质的量之比为28:5 |
6.下列装置能达到相应实验目的是( )
| A. | 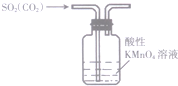 除去SO2中混有的CO2 | B. | 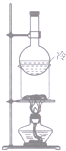 分离NH4Cl和Ca(OH)2固体 | ||
| C. | 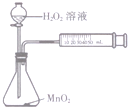 测定O2的生成速率 | D. | 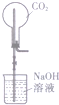 喷泉实验 |
5.下列各组顺序的排列不正确的是( )
| A. | 金属性:Na<Mg<Al | B. | 热稳定性:HCl>H2S>PH3 | ||
| C. | 酸性强弱:H2SiO3<H2CO3<HNO3 | D. | 碱性:Ba(OH)2>Ca(OH)2>Mg(OH)2 |