题目内容
13.下列排列顺序正确的是( )| A. | 粒子半径:Al3+>Mg2+>Na+ | B. | 热稳定性:HI>HBr>HCl>HF | ||
| C. | 酸性:H2CO3<H2SO4<HClO4 | D. | 碱性:Al(OH)3>Mg(OH) 2>NaOH |
分析 A、电子层结构相同的微粒,核电荷数越多半径越小;
B、中心元素非金属性越强,氢化物越稳定;
C、非金属性越强,最高价氧化物对应的水物的酸性越强;
D、金属性越强,对应最高价氧化物的水化物的碱性越强.
解答 解:A、三者的电子层结构相同,核电荷数铝最大,钠最小,所以粒子半径:Al3+<Mg2+<Na+,故A错误;
B、元素非金属性I<Br<Cl<F,所以氢化物越稳定性:HI<HBr<HCl<HF,故B错误;
C、非金属性C<S<C,所以最高价氧化物对应的水物的酸性:H2CO3<H2SO4<HClO4,故C正确;
D、金属性Na>Mg>Al,对应最高价氧化物的水化物的碱性为NaOH>Mg(OH)2>Al(OH)3,故D错误;
故选C.
点评 本题考查金属性和非金属性,明确物质的酸性、气态氢化物的稳定性,碱性与非金属性、金属性的关系是解答本题的关键,难度不大.

练习册系列答案
相关题目
5. 通过CO2电解固定技术有望减小室温效应并可得到多种燃料,其原因如图所示.下列说法中不正确的是( )
通过CO2电解固定技术有望减小室温效应并可得到多种燃料,其原因如图所示.下列说法中不正确的是( )
 通过CO2电解固定技术有望减小室温效应并可得到多种燃料,其原因如图所示.下列说法中不正确的是( )
通过CO2电解固定技术有望减小室温效应并可得到多种燃料,其原因如图所示.下列说法中不正确的是( )| A. | 阴极区溶液pH减小 | |
| B. | 当有6.72LO2(标况下)产生时转移的电子数为1.2mol | |
| C. | 电解时,生成乙烯的电极反应式是:2CO2+12e-+12H+=C2H4+4H2O | |
| D. | 该技术中能量转化方式主要有太阳能转化为电极及电能转化为化学能 |
6.下列装置能达到相应实验目的是( )
| A. | 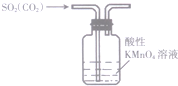 除去SO2中混有的CO2 | B. | 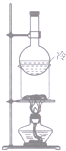 分离NH4Cl和Ca(OH)2固体 | ||
| C. | 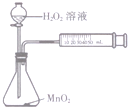 测定O2的生成速率 | D. | 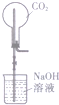 喷泉实验 |
1.第ⅤA族元素中的A、B两种元素所在周期分别最多可排18和8种元素,且B在A的上一周期,当A的原子序数为x时,B的原子序数为( )
| A. | x-18 | B. | x-8 | C. | x+8 | D. | x+18 |
18.用括号内的试剂除去下列各物质中少量的杂质,正确的是( )
| A. | 溴苯中的溴(碘化钾溶液) | B. | 硝基苯中溶有NO2(氢氧化钠溶液) | ||
| C. | 乙醇中的乙酸(饱和碳酸钠溶液) | D. | 苯中的苯酚(溴水) |
5.下列各组顺序的排列不正确的是( )
| A. | 金属性:Na<Mg<Al | B. | 热稳定性:HCl>H2S>PH3 | ||
| C. | 酸性强弱:H2SiO3<H2CO3<HNO3 | D. | 碱性:Ba(OH)2>Ca(OH)2>Mg(OH)2 |
2.已知甲醛(HCHO)分子中的4个原子是共平面的.下列分子中所有原子不可能同时存在于同一平面上的是( )
| A. | 苯乙烯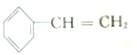 | B. | 苯甲酸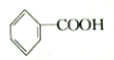 | C. | 苯甲醛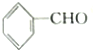 | D. | 苯乙酮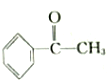 |
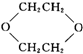 ,是一种常见的有机溶剂,它可以通过下列三步反应制得:
,是一种常见的有机溶剂,它可以通过下列三步反应制得: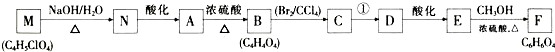
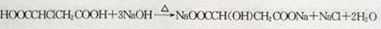 ;
;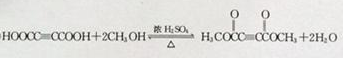 ,
,