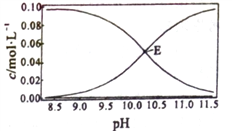
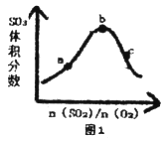
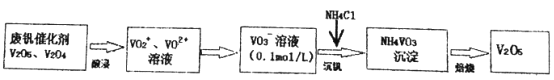
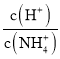题目内容
【题目】下列各组电极均用导线相连,分别插入对应溶质的溶液中,其中不能组成原电池的是
A | B | C | D | |
电极与溶液 | Zn、石墨、硫酸 | Cu、Ag、硝酸银 | Mg、Al、氢氧化钠 | Zn、Cu、蔗糖 |
A.AB.BC.CD.D
【答案】D
【解析】
A.锌是活泼金属,石墨能导电,锌和硫酸能自发的发生氧化还原反应,所以能形成原电池,故A不符合;
B.Cu活泼性大于银,Ag能导电,Cu和硝酸银溶液能自发的发生氧化还原反应,所以能形成原电池,故B不符合;
C.Al是活泼金属,Mg能导电,Al和氢氧化钠溶液能自发的发生氧化还原反应,所以能形成原电池,故C不符合;
D.蔗糖是非电解质,溶液不导电,不能作原电池的电解质,故D符合;
故选D。

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目
【题目】已知常温下,几种难溶电解质的溶度积(Ksp):
化学式 | Mg(OH)2 | MgF2 | Fe(OH)3 | AgCl | Cu(OH)2 | Ag2CrO4 |
溶度积 | 5.6×10-12 | 7.4×10-11 | 4 .0×10-38 | 1.8×10-10 | 2.2×10-20 | 2.0×10-12 |
下列说法不正确的是( )
A. 在Mg(OH)2 的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
B. 在Mg(OH)2 的悬浊液中加入NaF 溶液液后,Mg(OH)2 不可能转化为MgF2
C. CuCl2溶液中混入了一定量的FeCl3溶液,可以通过向溶液中加入CuO的方法,调整溶液的pH,除去Fe3+杂质
D. 向浓度均为1×10-3mol/L 的KCl 和K2CrO4混合液中滴加1×10-3mo/LAgNO3溶液,Cl-先形成沉淀