题目内容
【题目】关于溶液的下列说法不正确的是( )
A. 某温度下,Ba(OH)2溶液中Kw=10-12,向pH=8的该溶液中加入等体积pH=4的盐酸,充分反应后,混合溶液的pH=6
B. 水电离出来的c(H+)=10-13mol/L的溶液中K+、Cl-、NO3-、I-可能大量存在
C. 往0.1mol/LNH4Cl溶液中不断加入NaOH固体,随着NaOH的加入, 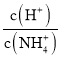 不断减小
不断减小
D. 一定温度下,氢氧化钙达到溶解平衡,向此溶液中加入少量氧化钙粉末(不考虑热效应),则溶液中c(Ca2+)减小
【答案】D
【解析】A.该温度下中性溶液pH=6,pH=8的氢氧化钡溶液中c(OH-)=10-4mol/L,pH=4的c(H+)=10-4mol/L,二者等体积混合,二者恰好反应导致溶液呈中性,故A正确;B.由水电离出来的c(H+)=1×10-13mol/L,c(H+)<10-7mol/L,说明水的电离被抑制,溶液可能是酸溶液也可能是碱溶液,如是酸溶液,溶液在中存在大量的H+离子,NO3-与I-能够发生氧化还原反应,不能大量共存,若溶液显碱性,K+、Cl-、NO3-、I-能大量共存,故B正确;C.铵根离子水解显酸性,结合水解平衡常数分析, 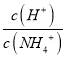 ×
×![]() =
=![]() ,随氢氧化钠固体加入,反应生成一水合氨浓度增大,平衡常数不变,则
,随氢氧化钠固体加入,反应生成一水合氨浓度增大,平衡常数不变,则 减小,故C正确;D.氧化钙与水反应生成氢氧化钙,仍然为氢氧化钙的饱和溶液,则溶液中c(Ca2+)不变,故D错误;故选D。
减小,故C正确;D.氧化钙与水反应生成氢氧化钙,仍然为氢氧化钙的饱和溶液,则溶液中c(Ca2+)不变,故D错误;故选D。

练习册系列答案
相关题目