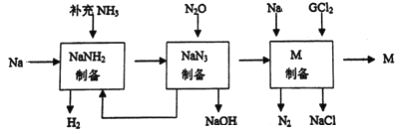
题目内容
【题目】化学上常用下图表示基本反应类型与氧化还原反应关系,其中阴影部分可以表示 ( )

A. 置换反应 B. 复分解反应 C. 所有的分解反应 D. 有电子转移的化合反应
【答案】D
【解析】
化学反应的四种基本类型:化合反应、分解反应、置换反应、复分解反应;根据四大基本反应类型和氧化还原反应之间的关系来回答;部分化合反应属于氧化还原反应,部分分解反应属于氧化还原反应
根据化合价是否发生变化,可以将化学反应分为氧化还原反应和非氧化还原反应;根据反应物、生成物的种类及其变化,可以将化学反应分为:化合反应、分解反应、置换反应、复分解反应。部分化合反应属于氧化还原反应,部分分解反应属于氧化还原反应,所有的置换反应均是氧化还原反应,所有的复分解反应均不是氧化还原反应,
A、所有的置换反应均是氧化还原反应,故A不选;
B、所有的复分解反应均不是氧化还原反应,故B不选;
C、所有的分解反应,只有部分分解反应属于氧化还原反应,故C不选;
D、有电子转移的化合反应,这部分化合反应属于氧化还原反应,故D符合;
故选D。

【题目】碳、氮等元素及其化合物和人类生产、生活密切相关,请回答下列问题:
(1)氨催化氧化是硝酸工业的基础,生产过程中会发生以下反应:
主反应:![]()
副反应:![]()
①工业上往往采用物料比![]() 在1.7—2.0之间,主要目的是____________。
在1.7—2.0之间,主要目的是____________。
②下表所示是部分化学键的键能参数:
化学键 | N-N | O=O |
键能/kJ· mol-1 | 946 | 497.3 |
则拆开1mol NO中的化学键需要吸收的能量是__________kJ。
(2)在一定温度下,向1L密闭恒容容器中充入l mol NO和一定物质的量的CO,在催化剂作用下发生反应:2NO (g)+2CO (g)![]() 2CO2(g)+N2(g) ΔH>0,NO的物质10 s随反应时间t的变化曲线如图:
2CO2(g)+N2(g) ΔH>0,NO的物质10 s随反应时间t的变化曲线如图:
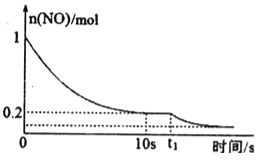
①前10 s内N2的平均生成速率为____。
②已知在t1时刻反应速率加快,则在t1时刻改变的条件可能是____。(填写一种)
(3)在723K时,将0.1mol H2和0.2mol CO2通入抽空的上述密闭容器中,发生如下反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),反应平衡后,水的物质的量分数为0.10。
CO(g)+H2O(g),反应平衡后,水的物质的量分数为0.10。
①CO2 的平衡转化率等于______,反应平衡常数K等于______(保留两位有效数字)。
②再向容器中加入过量的CoO (s)和Co (s),则容器中又会增加如下平衡:CoO (s) +H2 (g)![]() Co (s) +H2O(l)K1;CoO (s) +CO (g)
Co (s) +H2O(l)K1;CoO (s) +CO (g)![]() Co (s) +CO2(g) K2。最后反应平衡时,容器中水的物质的量分数为0. 30,则K1等于____。
Co (s) +CO2(g) K2。最后反应平衡时,容器中水的物质的量分数为0. 30,则K1等于____。
【题目】X、Y、Z、W四种短周期元素的有关数据如下表,下列叙述正确的是
元素代号 | X | Y | Z | W |
原子半径/pm | 66 | 70 | 143 | 160 |
主要化合价 | -2 | +5、+3、-3 | +3 | +2 |
A. X、Y、Z、W的离子半径由大到小的顺序为X>Y>W>Z
B. Y的最高价氧化物对应的水化物为强酸
C. Y的气态氢化物的稳定性高于X
D. 工业上采用电解熔融状态的Z的氯化物制备Z单质