题目内容
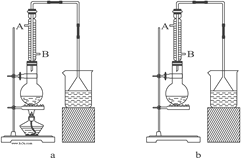
【题目】如图为原电池装置示意图:
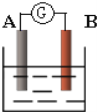
(1)若A为Zn,B为石墨棒,电解质溶液为稀硫酸,则A为________极(填正或负),写出电极反应式:正极_______________________,负极________________________.总反应为:____________________。
(2)若A为铜片,B为铁片,电解质为FeCl3溶液,则A为________极(填正或负),写出电极反应式:正极_____________________________,负极________________________.总反应为:_______________________________。
(3)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入H2和O2,该电池即为燃料电池,通入氧气的一极为该电池的________极(填正或负),该电池的总反应为:____________________
【答案】负 2H++2e-=H2↑ Zn-2e-=Zn2+ Zn+2H+=Zn2++H2↑ 正 Fe3++e-=Fe2+ Fe-2e-=Fe2+ 2Fe3++Fe=3Fe2+ 正 2H2+O2=2H2O
【解析】
(1)该原电池中,锌失电子变成离子进入溶液,所以锌极即A极为负极;石墨为正极,正极上氢离子得电子生成氢气,所以电极反应式为:2H++2e-=H2↑;负极电极反应式为:Zn-2e-=Zn2+;总反应为:Zn+2H+=Zn2++H2↑;
(2)该原电池中,铁片失电子变成二价铁离子进入溶液,B电极为负极,电极反应式为:Fe-2e-=Fe2+;铜片作正极,正极上三价铁离子得电子生成二价铁离子,电极反应式为:Fe3++e-=Fe2+;总反应为:2Fe3++Fe=3Fe2+;
(3)在原电池中失电子的一极为负极,得电子的一极为正极,在氢氧燃料电池中,氧气得电子,所以通入氧气的一极为该电池的正极;氢气和氧气反应生成水,所以电池反应式为:2H2+O2=2H2O。

 阅读快车系列答案
阅读快车系列答案