题目内容
9.X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大.请回答下列问题:(1)XZ2与YZ2分子的立体结构分别是V形和直线形,相同条件下两者在水中的溶解度较大的是SO2(写分子式).
(2)Q的元素符号是Cr,它的核外电子排布式为1s22s22p63s23p63d54s1,在形成化合物时它的最高化合价为+6;
(3)用氢键表示式写出E的氢化物溶液中存在的所有氢键F-H…F、F-H…O;O-H…F、O-H…O.
分析 X原子核外的M层中只有两对成对电子,核外电子排布应为1s22s22p63s23p4,则X为S元素;Y原子核外的L层电子数是K层的两倍,Y有2个电子层,最外层电子数为4,故Y为C元素;Z是地壳内含量最高的元素,则Z为O元素;Q的核电荷数是X与Z的核电荷数之和,其原子序数为24,故Q为Cr元素,E在元素周期表的各元素中电负性最大,应为F元素,据此答题.
解答 解:X原子核外的M层中只有两对成对电子,核外电子排布应为1s22s22p63s23p4,则X为S元素;Y原子核外的L层电子数是K层的两倍,Y有2个电子层,最外层电子数为4,故Y为C元素;Z是地壳内含量最高的元素,则Z为O元素;Q的核电荷数是X与Z的核电荷数之和,其原子序数为24,故Q为Cr元素,E在元素周期表的各元素中电负性最大,应为F元素.
(1)SO2中,S的价层电子对数为2+$\frac{6-2×2}{2}$=3,含有1对孤对电子,故空间结构为V形,CO2为直线形;SO2是极性分子,H2O也是极性分子,相似相溶,而CO2是非极性分子,故SO2在水中溶解度更大,
故答案为:V形;直线形;SO2;
(3)Q为Cr,原子序数为24,位于周期表第四周期ⅥB族,核外电子排布式为1s22s22p63s23p63d54s1,最高化合价为+6价,
故答案为:Cr;1s22s22p63s23p63d54s1;+6;
(4)HF的水溶液中,F的电负性较大,可与另一分子的HF或水中的H形成氢键,可表示为H-F…H,氧原子和氟化氢分子中的氢原子之间能形成氢键,可表示为 F-H…O,氟原子和水分子中的氢原子能形成氢键可表示为O-H…F,氧原子和另一个水分子中的氢原子能形成氢键可表示为O-H…O,
故答案为:F-H…F、F-H…O;O-H…F、O-H…O.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、空间构型、分子结构与性质、氢键等,题目难度不大,推断元素的种类是关键,注意掌握空间构型的判断.

 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案 在盛有少量无水乙醇的试管中,加入一小块新切的、擦干表面煤油的金属钠,迅速用配有导管的单孔塞塞住试管口,用一小试管收集并验纯气体后,点燃,并把干燥的小烧杯罩在火焰上,片刻,迅速倒转烧杯,向烧杯中加入少量澄清石灰水.观察现象,完成下表.
在盛有少量无水乙醇的试管中,加入一小块新切的、擦干表面煤油的金属钠,迅速用配有导管的单孔塞塞住试管口,用一小试管收集并验纯气体后,点燃,并把干燥的小烧杯罩在火焰上,片刻,迅速倒转烧杯,向烧杯中加入少量澄清石灰水.观察现象,完成下表.| 乙醇与钠反应的现象 | 气体燃烧的现象 | 结论 |
| ①Na沉到试管底部 ②反应有气泡产生 | 气体燃烧时火焰呈蓝色, 小烧杯内壁有水珠, 澄清石灰水不变浑浊. | 气体产物为H2 |
| A. | 1molCl2与足量Fe反应转移电子数一定为3NA | |
| B. | 标准状况下,22.4L NH3中含有共价键的数目为NA | |
| C. | 1.0L 1.0mol•L-1的Na2SiO3水溶液中含有的氧原子数为3NA | |
| D. | 4.6g Na完全转化成NaO和Na2O2的混合物,混合物中阴离子总数为0.1NA |
| A. | 纸上层析法通常以滤纸作为惰性支持物.滤纸纤维上的羟基具有亲水性,它所吸附的水作固定相 | |
| B. | 重结晶时,溶质的溶解度越大、溶液冷却速度越慢,得到的晶体颗粒越大 | |
| C. | 制备硫酸亚铁铵晶体需要将饱和硫酸铵溶液与新制硫酸亚铁溶液混合,加热蒸发,趁热过滤 | |
| D. | 在牙膏的浸泡液中加入新制碱性Cu(OH)2,溶液变绛蓝色 |
| A. | 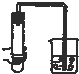 | B. |  | C. |  | D. | 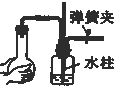 |
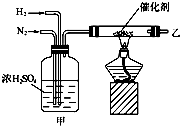 实验室合成氨的装置如图所示.
实验室合成氨的装置如图所示.
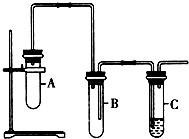 已知1,2-二氯乙烷常温下为无色液体,沸点83.5℃,密度1.23g/mL,难溶于水,易溶于醇、醚、丙酮等有机溶剂.乙醇的沸点为78.5℃.某化学课外活动小组为探究1,2-二氯乙烷的消去反应,设计了如图实验装置.请回答下列问题.
已知1,2-二氯乙烷常温下为无色液体,沸点83.5℃,密度1.23g/mL,难溶于水,易溶于醇、醚、丙酮等有机溶剂.乙醇的沸点为78.5℃.某化学课外活动小组为探究1,2-二氯乙烷的消去反应,设计了如图实验装置.请回答下列问题.