题目内容
【题目】某学生为比较镁、铝的金属性强弱,设计了如下实验:
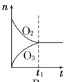
(1)向两支试管中分别加入3 mL同浓度的稀盐酸,再将两块大小相同且纯净的镁片和铝片分别加入试管中,反应初始时观察到如图所示的现象,则试管b内加入的金属为____________(写化学式)。

(2)若加入的两块金属的物质的量相等,且试管中稀盐酸足量,充分反应后,气球状态也如上图所示,则试管b中反应的离子方程式为___________。
(3)分析判断,实验________[填“(1)”或“(2)”]能证明镁的金属性强于铝。
【答案】Al Mg+2H+=Mg2++H2↑ (1)
【解析】
根据镁、铝的活泼性比较与酸反应的快慢,通过实验现象判断反应物,并根据离子方程式的书写规则书写相关反应离子方程式。
(1)大小相同的镁片、铝片分别与相同浓度的盐酸反应时,二者反应的剧烈程度不同,镁活泼反应更剧烈,所以反应初始时产生气体较多,所以a中是镁,b中是铝,化学式为Al,故答案为:Al;
(2)若加入的两块金属的物质的量相等,且试管中稀盐酸足量,充分反应后,根据反应方程式计算得,铝产生的气体多,则试管b中是镁,镁和盐酸反应生成氯化镁和氢气,反应的离子方程式为Mg+2H+=Mg2++H2↑,故答案为:Mg+2H+=Mg2++H2↑;
(3)大小相同的镁片、铝片分别与相同浓度的盐酸反应时,二者反应的剧烈程度不同,可说明镁、铝金属性强弱的不同,但产生气体的多少不能说明镁、铝金属性的强弱,所以实验(2)不能说明镁的金属性强,故答案为:(1)。

练习册系列答案
相关题目