题目内容
【题目】亚硝酰硫酸![]() 是染料、医药等工业的重要原料;溶于浓硫酸,可在浓硫酸存在时用
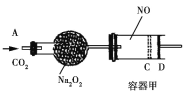
是染料、医药等工业的重要原料;溶于浓硫酸,可在浓硫酸存在时用![]() 和浓硝酸反应制得。实验室用如图装置制备少量亚硝酰硫酸(夹持装置略),并测定产品的纯度。
和浓硝酸反应制得。实验室用如图装置制备少量亚硝酰硫酸(夹持装置略),并测定产品的纯度。
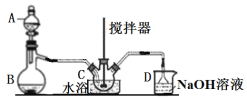
(1)仪器B的名称____________。
(2)B中产生SO2,其化学方程式为_______________________________________。
(3)三颈烧瓶C中浓硝酸与![]() 在浓硫酸作用下反应制得
在浓硫酸作用下反应制得![]()
①实验前浓硝酸和浓硫酸混合的操作为______________________________________。
②C中反应温度不能太高的原因为___________________________________。
③用冷水浴维持C温度不变,开始反应较慢,待生成少量![]() 后,反应明显加快,其原因可能是______________________。
后,反应明显加快,其原因可能是______________________。
(4)测定产品的纯度
准确称取1.5g产品放入锥形瓶中,加入![]() 、100.00mL的
、100.00mL的![]() 溶液和足量稀硫酸,摇匀充分反应。然后用0.5000mol/L草酸钠标准溶液滴定,消耗草酸钠溶液的体积为30.00mL。
溶液和足量稀硫酸,摇匀充分反应。然后用0.5000mol/L草酸钠标准溶液滴定,消耗草酸钠溶液的体积为30.00mL。
已知:![]()
①草酸钠与高锰酸钾溶液反应的离子方程式为__________________________________。
②滴定终点的现象为______________________________________________。
③亚硝酰硫酸的纯度![]() ________。[保留三位有效数字,M(NOSO4H)=127g/mol]
________。[保留三位有效数字,M(NOSO4H)=127g/mol]
【答案】蒸馏烧瓶 Na2SO3+H2SO4=Na2SO4+H2O+SO2↑ 将浓硫酸缓缓加入浓硝酸,边加边搅拌 温度太高,浓硝酸会挥发和分解 生成的![]() 作为该反应的催化剂 2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O 滴入最后一滴
作为该反应的催化剂 2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O 滴入最后一滴![]() 溶液后,溶液由浅紫色变为无色且半分钟颜色不恢复 84.67%
溶液后,溶液由浅紫色变为无色且半分钟颜色不恢复 84.67%
【解析】
(1)仪器B的名称为蒸馏烧瓶。
(2)B中为固体与液体反应产生SO2,所以应为亚硫酸钠与硫酸反应。
(3)①实验前浓硝酸和浓硫酸混合的操作,类似于浓硫酸稀释。
②C中反应温度不能太高,主要从浓硝酸的性质进行分析。
③温度不变,开始反应较慢,待生成少量![]() 后,反应明显加快,应考虑可能是催化作用。
后,反应明显加快,应考虑可能是催化作用。
(4) ①草酸钠与高锰酸钾溶液反应,生成Mn2+、CO2和H2O。
②滴定终点时,起初为浅紫色,则后来为无色。
③先利用草酸钠求出过量KMnO4的物质的量,再求出与![]() 反应的KMnO4的物质的量,从而求出亚硝酰硫酸的纯度。
反应的KMnO4的物质的量,从而求出亚硝酰硫酸的纯度。
(1)仪器B的名称蒸馏烧瓶。答案为:蒸馏烧瓶;
(2)B中Na2SO3与H2SO4反应生成SO2,其化学方程式为Na2SO3+H2SO4
=Na2SO4+H2O+SO2↑。答案为:Na2SO3+H2SO4=Na2SO4+H2O+SO2↑;
(3)①实验前浓硝酸和浓硫酸混合,相当于浓硫酸稀释,其操作为将浓硫酸缓缓加入浓硝酸中,边加边搅拌。答案为:将浓硫酸缓缓加入浓硝酸中,边加边搅拌;
②C中反应温度不能太高的原因为温度太高,浓硝酸会挥发和分解。答案为:温度太高,浓硝酸会挥发和分解;
③用冷水浴维持C温度不变,开始反应较慢,待生成少量![]() 后,反应明显加快,其原因可能是生成的
后,反应明显加快,其原因可能是生成的![]() 作为该反应的催化剂。答案为:生成的
作为该反应的催化剂。答案为:生成的![]() 作为该反应的催化剂;
作为该反应的催化剂;
(4)①草酸钠与高锰酸钾溶液反应的离子方程式为2MnO4-+5C2O42-+16H+
=2Mn2++10CO2↑+8H2O。答案为:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O;
②滴定终点的现象为滴入最后一滴![]() 溶液后,溶液由浅紫色变为无色且半分钟颜色不恢复。答案为:滴入最后一滴
溶液后,溶液由浅紫色变为无色且半分钟颜色不恢复。答案为:滴入最后一滴![]() 溶液后,溶液由浅紫色变为无色且半分钟颜色不恢复;
溶液后,溶液由浅紫色变为无色且半分钟颜色不恢复;
③设与C2O42-反应的MnO4-的物质的量为x
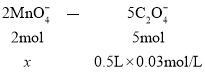
从而求出x=0.006mol,则与![]() 反应的KMnO4物质的量为0.01mol-0.006mol
反应的KMnO4物质的量为0.01mol-0.006mol
=0.004mol。
设![]() 的物质的量为y
的物质的量为y
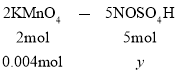
从而求出y=0.01mol,亚硝酰硫酸的纯度![]()
![]() =84.67%。答案为:84.67%。
=84.67%。答案为:84.67%。

【题目】用方铅矿(主要成分为PbS,含有杂质FeS等)和软锰矿(主要成分为MnO2,还有少量Fe2O3,Al2O3等杂质) 制备PbSO4和Mn3O4的工艺流程如下:

已知:①浸取中主要反应:PbS+MnO2+4HCl=MnCl2+PbCl2+S+2H2O
②PbCl2难溶于冷水,易溶于热水;PbCl2 (s)+2Cl-(aq)![]() PbCl42-(aq) △H>0
PbCl42-(aq) △H>0
③Mn3O4是黑色不溶于水的固体,制备原理为:6MnCl2+O2+12NH3H2O=2Mn3O4↓+12NH4Cl+6H2O
④部分金属离子开始沉淀和沉淀完全的pH如下(开始沉淀的pH按金属离子浓度为0.1mol·L1计算)。
金属离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ |
开始沉淀的pH | 7.6 | 2.7 | 4.0 | 7.7 |
沉淀完全的pH | 9.6 | 3.7 | 5.2 | 9.8 |
(1)“浸取”需控制温度在80℃左右,为加快酸浸速率,还可采用的方法是______。
(2)加入饱和NaCl溶液的目的是______。
(3)“浸取”过程中MnO2将Fe2+氧化的离子方程式为______。
(4)用MnCO3调节溶液pH的范围为______。
(5)“趁热抽滤”的目的是______。
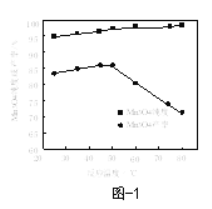
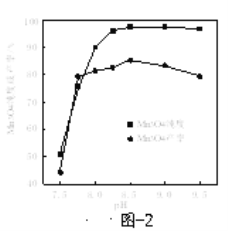
(6)已知:反应温度和溶液pH对Mn3O4的纯度和产率影响分别如图1、图2所示,请补充完整由滤液X制备Mn3O4的实验方案:______,真空干燥4小时得产品Mn3O4。(实验中须使用的试剂:氨水、空气)