题目内容
【题目】运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义。
(1)用CO可以合成甲醇。已知:
CH3OH(g)+3/2O2(g)===CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
CO(g)+1/2O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
H2(g)+1/2O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
则CO(g)+2H2(g) ![]() CH3OH(g) ΔH=______kJ·mol-1。
CH3OH(g) ΔH=______kJ·mol-1。
(2)下列措施中能够增大上述合成甲醇反应速率的是________(填写序号)。
a.使用高效催化剂 b.降低反应温度
c.增大体系压强 d.不断将CH3OH从反应混合物中分离出来
(3)在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系
如右图所示。

①p1________p2(填“大于”、“小于”或“等于”);
②100 ℃时,该反应的化学平衡常数K=________;
③在其他条件不变的情况下,再增加a mol CO和2a mol H2,达到新平衡时,CO的转化率________(填“增大”、“减小”或“不变”)。
(4)某科研小组用SO2为原料制取硫酸。
①利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触。请写出该电池负极的电极反应式:_____________________。
②用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸。电解原理示意图如下。请写出开始时阳极反应的电极反应式:_________________。

【答案】(1)-90.1
(2)ac
(3)①小于 ②(V/a)2(2分) ③增大
(4)①SO2+2H2O-2e-===SO42-+4H+
②HSO3-+H2O-2e-===SO42-+3H+
【解析】
试题分析:(1)
①CH3OH(g)+3/2O2(g)===CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
② CO(g)+1/2O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
③H2(g)+1/2O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
根据盖斯定律,②+2×③-①得CO(g)+2H2(g) ![]() CH3OH(g)
CH3OH(g)
ΔH=-283.0-285.8×2+764.5 =-90.1kJ·mol-1;
(2)下列措施中能够增大上述合成甲醇反应速率的是ac。
a.使用高效催化剂能加快反应速率
b.降低反应温度,使反应速率减慢
c.增大体系压强,能加快反应速率
d.不断将CH3OH从反应混合物中分离出来,浓度减小,速率减慢;
(3)在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如右图所示。①增大压强,平衡向气体系数和减小的方向移动,CO的转化率增大,所以p1小于p2;
②
100 ℃时,该反应的化学平衡常数K= (V/a)2;
(V/a)2;
③在其他条件不变的情况下,再增加a mol CO和2a mol H2,相当于加压,平衡正向移动,达到新平衡时,CO的转化率增大。
(4)某科研小组用SO2为原料制取硫酸。
①利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触。电池负极发生氧化反应,电池负极的电极反应式:SO2+2H2O-2e-===SO42-+4H+。
②用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸。电解池阳极发生氧化反应,阳极反应的电极反应式:HSO3-+H2O-2e-===SO42-+3H+。

【题目】有机物中,有一些分子式符合通式CnHn,如C2H2、C6H6等。
(1)关于这些有机物的说法中正确的是______(填编号)。
A.可能互为同系物 |
B.在空气中燃烧时火焰明亮且产生黑烟 |
C.一定能使高锰酸钾酸性溶液褪色 |
D.等质量的这些有机物完全燃烧时耗氧量相同 |
(2)写出分子式为C4H4且为链烃的有机物的结构简式__________,它的一氯代物的同分异构体有________种。
(3)写出除苯外分子式为C6H6且结构中只有C—C键和C—H键的有机物的结构简式:____________________________________________________________。
(4)某有机物分子式为C8H8,且属于芳香烃,已知它可使高锰酸钾酸性溶液和溴水褪色,则该有机物的结构简式为________,写出其发生加聚反应的化学方程式:____________________________________。
【题目】Ⅰ下列单元操作中采用了热交换设计的有
A.电解食盐水制烧碱 |
B.合成氨中的催化合成 |
C.硫酸生产中的催化氧化 |
D.氨碱法中的氨盐水碳酸化 |
Ⅱ海水晒盐的卤水中还有氯化镁,以卤水为原料生产镁的一中工艺流程如下图所示。
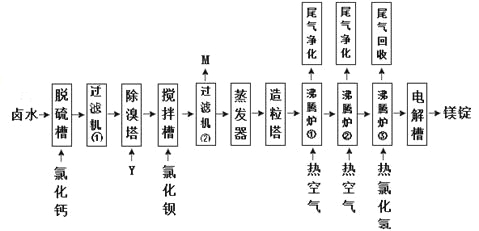
回答下列问题:
(1)脱硫槽、搅拌槽均用于脱除卤水中的(填离子符号),M的主要成分是(填化学式)。
(2)除溴塔中主要的离子方程式为。
(3)沸腾炉①和②的主要作用是。沸腾炉③通入热氯化氢的主要目的是。
(4)电解槽中阴极的电极反应方程式为。
(5)电解槽中阳极产物为,该产物可直接用于本工艺流程中的。