题目内容
 工业上将烟气中的二氧化硫转化为硫,常用的两种方法分别是热解气还原法和离子膜电解法.
工业上将烟气中的二氧化硫转化为硫,常用的两种方法分别是热解气还原法和离子膜电解法.(1)热解气还原法即用生物质热解气(主要成分为CO、H2)将SO2在高温下还原成单质硫.已知CO还原SO2生成S(g)和CO2过程中,每转移1mol电子需吸收2.0kJ的热量,则该反应的热化学方程式为
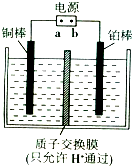
(2)离子膜电解法处理烟气中SO2的过程是:先用Na2SO4溶液吸收烟气中的SO2,再用离子膜电解法电解吸收液得到单质硫,同时在阳极得到副产物氧气.其装置如图所示.
①b为电源的
②用Na2SO4溶液代替水吸收烟气中的SO2使之转化为H2SO3,其目的是
③电解过程中,阴极的电极反应式为
考点:热化学方程式,电解原理
专题:化学反应中的能量变化
分析:(1)已知CO还原SO2生成S(g)和CO2过程中,每转移1mol电子需吸收2.0kJ的热量,则转移2mol电子需要吸收能量8KJ,依据热化学方程式书写方法,标注物质聚集状态和对应反应的焓变写出;
(2)①用离子膜电解法电解吸收液得到单质硫,硫元素化合价降低分数还原反应,在电解池的阴极,同时在阳极得到副产物氧气,是溶液中氢氧根离子失电子生成氧气,所以铜电极做阴极,铂棒做阳极,电源正极解阳极,电源阴极接阴极;
②从溶液导电能力和电解原理分析;
③阴极是二氧化硫在酸性溶液中得到电子生成单质硫,依据通过质子交换膜的离子数为1.204×1024个
(2)①用离子膜电解法电解吸收液得到单质硫,硫元素化合价降低分数还原反应,在电解池的阴极,同时在阳极得到副产物氧气,是溶液中氢氧根离子失电子生成氧气,所以铜电极做阴极,铂棒做阳极,电源正极解阳极,电源阴极接阴极;
②从溶液导电能力和电解原理分析;
③阴极是二氧化硫在酸性溶液中得到电子生成单质硫,依据通过质子交换膜的离子数为1.204×1024个
解答:
解:(1)CO还原SO2生成S(g)和CO2过程中,每转移1mol电子需吸收2.0kJ的热量,则转移4mol电子需要吸收能量8KJ,依据热化学方程式书写方法得到热化学方程式为:2CO(g)+SO2(g)═S(g)+2CO2(g)△H=+8.0 kJ?mol-1;
故答案为:2CO(g)+SO2(g)═S(g)+2CO2(g)△H=+8.0 kJ?mol-1;
(2)①用离子膜电解法电解吸收液得到单质硫,硫元素化合价降低分数还原反应,在电解池的阴极,同时在阳极得到副产物氧气,是溶液中氢氧根离子失电子生成氧气,所以铜电极做阴极,铂棒做阳极,电源正极解阳极,电源阴极接阴极,b为电源正极;
故答案为:正极;
②Na2SO4溶液代替水吸收烟气中的SO2使之转化为H2SO3,电解过程中增强溶液导电能力,其目的是提高溶液的导电能力,加快电解速率;
故答案为:提高溶液的导电能力,加快电解速率;
③阴极是二氧化硫在酸性溶液中得到电子生成单质硫,电极反应为:SO2+4H++4e-═S+2H2O;通过质子交换膜的离子数为1.204×1024个物质的量=
=2mol,依据电极反应中定量关系计算每4mol氢离子交换生成硫单质1mol,则2mol氢离子交换生成硫单质0.5mol,质量=0.5mol×32g/mol=16g;
故答案为:SO2+4H++4e-═S+2H2O;16g;
故答案为:2CO(g)+SO2(g)═S(g)+2CO2(g)△H=+8.0 kJ?mol-1;
(2)①用离子膜电解法电解吸收液得到单质硫,硫元素化合价降低分数还原反应,在电解池的阴极,同时在阳极得到副产物氧气,是溶液中氢氧根离子失电子生成氧气,所以铜电极做阴极,铂棒做阳极,电源正极解阳极,电源阴极接阴极,b为电源正极;
故答案为:正极;
②Na2SO4溶液代替水吸收烟气中的SO2使之转化为H2SO3,电解过程中增强溶液导电能力,其目的是提高溶液的导电能力,加快电解速率;
故答案为:提高溶液的导电能力,加快电解速率;
③阴极是二氧化硫在酸性溶液中得到电子生成单质硫,电极反应为:SO2+4H++4e-═S+2H2O;通过质子交换膜的离子数为1.204×1024个物质的量=
| 1.204×1024 |
| 6.03×1023 |
故答案为:SO2+4H++4e-═S+2H2O;16g;
点评:本题考查了热化学方程式和盖斯定律计算应用,电解原理分析判断,电解过程中电子守恒的计算应用,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
下列指定溶液中,各组离子可能大量共存的是( )
| A、pH=1的溶液中:K+、Fe2+、Cl-、NO3- |
| B、在强酸溶液中:Na+、ClO-、Cl-、Ba2+ |
| C、在含有大量Fe3+的溶液中:NH4+、Cl-、Na+、SCN- |
| D、由水电离的c(H+)=10-13mol?L-1的溶液中:Mg2+、Cl-、K+、SO42- |
下列不属于氧化还原反应的是( )
| A、2KMnO4+5SO2+2H2O═K2SO4+2MnSO4+2H2SO4 |
| B、工业制漂白粉 |
| C、氯碱工业制氯气 |
| D、Na2O2+2HCl═2NaCl+H2O2 |