题目内容
常温下,0.1mol?L-1的氨水的PH约为11,向其中加入氯化铵晶体,待晶体溶解后发现溶液的PH减小.
对上述现象甲、乙两同学提出不同的观点:
(1)甲同学认为NH4Cl水解呈酸性,导致 增大,因而溶液的PH减小;
乙同学认为NH4Cl溶于水电离出大量NH4+离子,抑制了NH3?H2O的电离,使 减小,因此溶液的PH减小.
(2)①丙同学为了验证上述甲、乙两位同学观点,继续做如下实验:
向0.1mol?L-1氨水中加入少量下列物质 (填写编号),然后测定溶液的PH(已知常温时,CH3COONH4溶液呈中性).
A、固体(NH4)2SO4 B、固体CH3COONH4 C、气体HCl D、固体FeCl3
②常温下将0.010mol NH4Cl和0.004mol NaOH溶于水,配制成0.5L混合溶液.判断:(假设氨气不逸出)
a.溶液存在的分子有 (写分子式)
b.其中有三种粒子的物质的量之和一定等于0.010mol,它们是 、 和 .
c.溶液中n(NH4+)+n(H+)-n(OH-)= mol.
对上述现象甲、乙两同学提出不同的观点:
(1)甲同学认为NH4Cl水解呈酸性,导致
乙同学认为NH4Cl溶于水电离出大量NH4+离子,抑制了NH3?H2O的电离,使
(2)①丙同学为了验证上述甲、乙两位同学观点,继续做如下实验:
向0.1mol?L-1氨水中加入少量下列物质
A、固体(NH4)2SO4 B、固体CH3COONH4 C、气体HCl D、固体FeCl3
②常温下将0.010mol NH4Cl和0.004mol NaOH溶于水,配制成0.5L混合溶液.判断:(假设氨气不逸出)
a.溶液存在的分子有
b.其中有三种粒子的物质的量之和一定等于0.010mol,它们是
c.溶液中n(NH4+)+n(H+)-n(OH-)=
考点:弱电解质在水溶液中的电离平衡,盐类水解的应用
专题:电离平衡与溶液的pH专题
分析:(1)铵根离子水解生成氢离子,导致C(H+)增大;NH4+离子,抑制了NH3?H2O的电离,导致C(OH-) 减小;
(2)①要判断哪一种解释正确,可加入一种含有CH3COO-但溶液不显碱性的盐;
②a.二者反应,导致溶液中的溶质是0.006mol NH4Cl、0.004mol NaCl、0.004molNH3.H2O;
b.溶液中存在物料守恒,根据物料守恒判断;
c.溶液中存在电荷守恒,根据电荷守恒判断.
(2)①要判断哪一种解释正确,可加入一种含有CH3COO-但溶液不显碱性的盐;
②a.二者反应,导致溶液中的溶质是0.006mol NH4Cl、0.004mol NaCl、0.004molNH3.H2O;
b.溶液中存在物料守恒,根据物料守恒判断;
c.溶液中存在电荷守恒,根据电荷守恒判断.
解答:
解(1)铵根离子水解生成氢离子,导致C(H+) 增大,溶液的pH减小;NH4+离子,抑制了NH3?H2O的电离,导致C(OH-) 减小,氢离子浓度增大,溶液的pH减小,
故答案为:C(H+);C(OH-);
(2)①CH3COONH4溶液中,CH3COO-和NH4+都发生水解,且水解程度相等,CH3COONH4溶液呈中性,将CH3COONH4加入到0.1 mol?L-1醋酸中使pH增大,说明CH3COO-抑制了醋酸的电离,其它物质的水溶液都呈酸性,不能用于证明,
故答案为:B;
②a.二者反应,导致溶液中的溶质是0.006mol NH4Cl、0.004mol NaCl、0.004molNH3.H2O,一水合氨不稳定,易分解生成氨气,所以溶液中存在的分子有NH3、H2O、NH3.H2O,所以有三种分子,故答案为:NH3、H2O、NH3.H2O;
b.溶液中存在物料守恒,根据物料守恒得c(NH3)+c(NH4+)+c(NH3?H2O)=0.010mol,故答案为:NH3;NH4+;NH3?H2O;
c.溶液中存在电荷守恒,根据电荷守恒得n(NH4+)+n(H+)-n(OH-)=n(Na+)=0.006mol,故答案为:0.006.
故答案为:C(H+);C(OH-);
(2)①CH3COONH4溶液中,CH3COO-和NH4+都发生水解,且水解程度相等,CH3COONH4溶液呈中性,将CH3COONH4加入到0.1 mol?L-1醋酸中使pH增大,说明CH3COO-抑制了醋酸的电离,其它物质的水溶液都呈酸性,不能用于证明,
故答案为:B;
②a.二者反应,导致溶液中的溶质是0.006mol NH4Cl、0.004mol NaCl、0.004molNH3.H2O,一水合氨不稳定,易分解生成氨气,所以溶液中存在的分子有NH3、H2O、NH3.H2O,所以有三种分子,故答案为:NH3、H2O、NH3.H2O;
b.溶液中存在物料守恒,根据物料守恒得c(NH3)+c(NH4+)+c(NH3?H2O)=0.010mol,故答案为:NH3;NH4+;NH3?H2O;
c.溶液中存在电荷守恒,根据电荷守恒得n(NH4+)+n(H+)-n(OH-)=n(Na+)=0.006mol,故答案为:0.006.
点评:本题考查了弱电解质的电离和盐类水解,根据溶液酸碱性再结合守恒思想分析解答,难点是设计实验判断氯化铵溶液呈酸性的原因,根据物质的性质解答,题目难度中等.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
关于苯的下列说法正确的是( )
| A、苯的分子是环状结构,其性质跟环烷烃相似 |
B、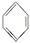 表示苯的分子结构,其中含有碳碳双键,因此苯的性质跟烯烃相同 表示苯的分子结构,其中含有碳碳双键,因此苯的性质跟烯烃相同 |
| C、苯的分子式是C6H6,分子中的C原子远没有饱和,因此能使溴水褪色 |
| D、苯环上的碳碳键的键能、键长介于单双键之间 |
举世闻名的秦兵马俑制品的主要材料在成分上属于( )
| A、氧化铝 | B、二氧化硅 |
| C、硅酸盐 | D、合金 |
某同学用一小块铝片和盐酸反应制取H2,实验现象如下表:
反应1~15min内,铝与盐酸的反应速率变化的可能原因是( )
| 时间 | 1min | 2min | 5min | 15min | 20min |
| 现象 | 少量气泡 | 较多气泡 | 大量气泡 | 反应剧烈 | 铝片耗尽 |
| A、该反应是放热反应,温度升高 |
| B、反应过程中盐酸的浓度增大 |
| C、随着反应的进行,铝片表面积变小 |
| D、Cl-离子是该反应的催化剂 |
下列相关表达正确的是( )
| A、亚硫酸的电离方程式:H2SO3=2H++SO2-3 | ||
B、中子数为18的氯原子的原子符号:
| ||
| C、(CH3)2CHCH2CH2OH的名称:3-甲基-1-丁醇 | ||
D、HOCH2COOH缩聚产物的结构简式: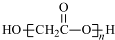 |
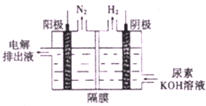 氢气是一种清洁能源,氢气的制取与利用是氢能源领域的研究热点
氢气是一种清洁能源,氢气的制取与利用是氢能源领域的研究热点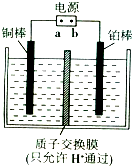 工业上将烟气中的二氧化硫转化为硫,常用的两种方法分别是热解气还原法和离子膜电解法.
工业上将烟气中的二氧化硫转化为硫,常用的两种方法分别是热解气还原法和离子膜电解法.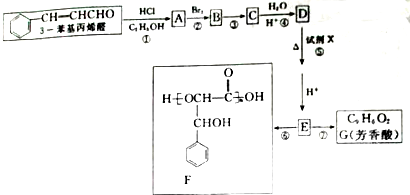
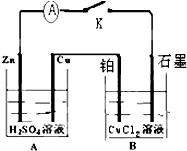 如图,回答问题:
如图,回答问题: