题目内容
13. 氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:Cl2+H2O?HCl+HClO K=4.5×10-4次氯酸的强氧化性能杀死水中的病菌.但是,由于氯气贮运不方便,且具有一定的危险性,目前正逐渐被其他性能优越的消毒产品所替代.请回答:
氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:Cl2+H2O?HCl+HClO K=4.5×10-4次氯酸的强氧化性能杀死水中的病菌.但是,由于氯气贮运不方便,且具有一定的危险性,目前正逐渐被其他性能优越的消毒产品所替代.请回答:(1)氯碱工业生产氯气的化学方程式为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑.
(2)84消毒液与氯气相比具有贮运方便等优点,用氯气与烧碱溶液反应制备84消毒液的离子方程式为Cl2+2OH-═Cl-+ClO-+H2O.
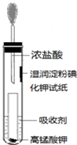
(3)一位同学设计了一套用浓盐酸和KMnO4固体制取少量氯气并比较氯气与碘单质的氧化性强弱的微型装置(如图).
①下列溶液能吸收Cl2的是BC(填字母序号).
A.饱和食盐水 B.饱和Na2SO3溶液
C.饱和NaOH溶液 D.浓硫酸
②能说明Cl2的氧化性强于I2的实验现象是湿润淀粉碘化钾试纸变蓝.
③Cl2中含有少量HCl气体,可用饱和食盐水试剂除去HCl,请用平衡移动的原理解释原因:增大Cl-浓度,Cl2+H2O?HCl+HClO平衡会逆向移动,有效降低Cl2在饱和食盐水中的溶解度.
(4)若实验室用200mL 10mol•L-1的浓盐酸与足量的二氧化锰固体加热反应(不考虑浓盐酸挥发),则产生氯气的物质的量为小于 0.5mol(填“大于”、“等于”或“小于”),原因是反应产生水将浓盐酸不断稀释成稀盐酸而稀盐酸不与二氧化锰反应生成氯气.
分析 (1)氯碱工业用电解饱和食盐水的方法制备氯气;
(2)氯气与烧碱溶液反应生成NaCl和NaClO;
(3)①根据氯气具有氧化性以及能与碱反应的性质判断;
②可用淀粉碘化钾试纸检验;
③氯水中存在Cl2+H2O?HCl+HClO平衡,为可逆反应,根据浓度对平衡一定的影响分析.
(4)浓盐酸有强还原性,而稀盐酸没有还原性,随反应的进行浓盐酸变成稀酸.
解答 解:(1)氯碱工业用电解饱和食盐水的方法制备氯气,反应的方程式为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑,
故答案为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑;
(2)氯气与烧碱溶液反应生成NaCl和NaClO,反应的离子方程式为Cl2+2OH-═Cl-+ClO-+H2O,
故答案为:Cl2+2OH-═Cl-+ClO-+H2O;
(3)①A.氯气难溶于饱和食盐水,故A错误;
B.氯气具有氧化性,可与饱和Na2SO3溶液发生氧化还原反应而被吸收,故B正确;
C.氯气和与饱和NaOH溶液反应而被吸收,故C正确;
D.浓硫酸与氯气不反应,不能吸收氯气,故D错误.
故答案为:BC;
②氯气可氧化KI生成单质碘,淀粉遇碘变蓝色,则可用湿润淀粉碘化钾试纸检验,现象为试纸变蓝,
故答案为:湿润淀粉碘化钾试纸变蓝;
③氯水中存在Cl2+H2O?HCl+HClO平衡,为可逆反应,饱和食盐水中Cl-抑制氯气与水的反应,平衡会逆向移动,有效降低Cl2在饱和食盐水中的溶解度,
故答案为:饱和食盐水;增大Cl-浓度,Cl2+H2O?HCl+HClO平衡会逆向移动,有效降低Cl2在饱和食盐水中的溶解度.
(4)浓盐酸中含有HCl:0.2L×10mol/L═2mol根据化学方程式:MnO2+4HCl$\frac{\underline{\;加热\;}}{\;}$MnCl2+Cl2↑+2H2O可知在二氧化锰过量的条件下,如果HCl完全反应,会生成氯气0.5mol,但是浓盐酸与二氧化锰反应成为稀盐酸后将不会反应生成氯气,即生成的氯气会小于0.5mol,故答案为:小于;反应产生水将浓盐酸不断稀释成稀盐酸而稀盐酸不与二氧化锰反应生成氯气.
点评 本题考查较为综合,涉及氯气的制备、性质以及检验等题目,难度中等,学习中注意相关基础知识的积累.

| A. | 含有6.02×1023个Cl2分子 | B. | 气体体积为22.4L | ||
| C. | 含有1.204×1024个Cl原子 | D. | 气体质量为35.5g |
| 叙述Ⅰ | 叙述Ⅱ | |
| A | NaHCO3能与碱反应 | 食品工业用NaHCO3作焙制糕点的膨松剂 |
| B | Al既可和酸反应又可和强碱反应 | Al可制成铝箔包装物品 |
| C | 浓硫酸有吸水性 | 浓硫酸可干燥CO、SO3、H2S |
| D | K2FeO4能与水作用生成Fe(OH)3胶体和O2 | 可K2FeO4用于净化自来水并杀菌消毒 |
| A. | A | B. | B | C. | C | D. | D |
①蛋白质溶液中加入硫酸铵后形成沉淀 ②将饱和氯水滴到蓝色石蕊试纸上
③二氧化氮经加压凝成无色液体 ④溴水滴入植物油中振荡褪色
⑤胆矾风化 ⑥除去混在氢氧化铁胶体中的氯化铁.
| A. | ①②③ | B. | ①④⑥ | C. | ③⑤ | D. | ①⑥ |
| A. | 质量数为34、中子数为18的核素:${\;}_{16}^{34}$S | |
| B. | S2-的结构示意图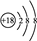 | |
| C. | CS2的结构式:S-C-S | |
| D. | 亚硫酸的电离方程式:H2SO3?2H++SO${\;}_{3}^{2-}$ |
| A. | 浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗 | |
| B. | 金属汞一旦洒落到实验室地面或桌面时,必须尽可能收集,并深埋处理 | |
| C. | 金属钠着火时用泡沫灭火器灭火 | |
| D. | 加工后具有吸水性的植物纤维可用作食品干燥剂 |
 .
. 过氧化氢是用途很广的绿色氧化剂,它的水溶液俗称双氧水,常用于消毒、杀菌、漂白等.试回答下列问题:
过氧化氢是用途很广的绿色氧化剂,它的水溶液俗称双氧水,常用于消毒、杀菌、漂白等.试回答下列问题: .
.