题目内容
2.下列有关硫元素及其化合物的表示正确的是( )| A. | 质量数为34、中子数为18的核素:${\;}_{16}^{34}$S | |
| B. | S2-的结构示意图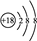 | |
| C. | CS2的结构式:S-C-S | |
| D. | 亚硫酸的电离方程式:H2SO3?2H++SO${\;}_{3}^{2-}$ |
分析 A.质量数为34、中子数为18的核素,其质子数为16,为S原子;
B.硫离子的核电荷数为16,不是18;
C.CS2中含有两个C=S键;
D.亚硫酸为二元弱酸,在溶液中部分电离出氢离子和亚硫酸氢根离子.
解答 解:A.该核素的核电荷数为16,是S原子,该核素可以表示为:${\;}_{16}^{34}$S,故A正确;
B.S2-的质子数为16,核外电子数为18,各层电子数分别为2、8、8,硫离子结构示意图为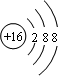 ,故B错误;
,故B错误;
C.CS2的电子式类似于CO2,电子式为 ,其结构式为:S=C=S,故C错误;
,其结构式为:S=C=S,故C错误;
D.亚硫酸为二元弱酸,在溶液中部分电离出氢离子和亚硫酸氢根离子,其电离方程式为:H2SO3?H++HSO3-,故D错误;
故选A.
点评 本题考查了常见化学用语的表示方法判断,题目难度中等,涉及离子结构示意图、元素符号、结构式、电离方程式等知识,明确常见化学用语的概念及书写原则为解答关键,试题培养了学生规范答题能力.

练习册系列答案
相关题目
12.识别安全使用标志很重要.油罐车上应使用的标志是( )
| A. |  | B. |  | C. |  | D. |  |
10.事实上,许多非金属氧化物在一定条件下能与Na2O2反应,且反应极有规律,如Na2O2+SO2═Na2SO4
2Na2O2+2SO3═2Na2SO4+O2据此,你认为下列反应方程式中正确的是( )
2Na2O2+2SO3═2Na2SO4+O2据此,你认为下列反应方程式中正确的是( )
| A. | 2Na2O2+2N2O4═4NaNO3 | B. | Na2O2+2NO2═2NaNO2+O2 | ||
| C. | 2Na2O2+2N2O3═4NaNO2+O2 | D. | 2Na2O2+2 Mn2O7═4Na2MnO4+O2 |
7.下列物质的转化在给定条件下不能实现的是( )
| A. | A、Ca(ClO)2(aq)$\stackrel{CO_{2}}{→}$HClO(aq)$\stackrel{光照}{→}$HCl(aq) | |
| B. | NH3$→_{催化剂△}^{O_{2}}$NO$\stackrel{O_{2}}{→}$NO2$\stackrel{H_{2}O}{→}$HNO3 | |
| C. | Fe$→_{△}^{少量Cl_{2}}$FeCl2$\stackrel{NaOH溶液}{→}$Fe(OH)2$\stackrel{空气中放置}{→}$Fe(OH)3 | |
| D. | H2SiO3$\stackrel{△}{→}$SiO2$\stackrel{NaOH(aq)}{→}$Na2SiO3 |
11.下列有关化学用语表示错误的是( )
| A. | HCN的结构式:H-C≡N | |
| B. | S2-的结构示意图: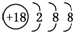 | |
| C. | HClO的电子式: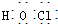 | |
| D. | 质子数为86、中子数为51的铯原子:$\stackrel{137}{86}$Cs |
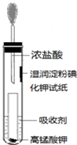 氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:Cl2+H2O?HCl+HClO K=4.5×10-4次氯酸的强氧化性能杀死水中的病菌.但是,由于氯气贮运不方便,且具有一定的危险性,目前正逐渐被其他性能优越的消毒产品所替代.请回答:
氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:Cl2+H2O?HCl+HClO K=4.5×10-4次氯酸的强氧化性能杀死水中的病菌.但是,由于氯气贮运不方便,且具有一定的危险性,目前正逐渐被其他性能优越的消毒产品所替代.请回答:
 氮可以形成多种化合物,如NO、NH3、N2H4、HCN、NH4NO3等.
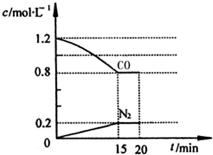
氮可以形成多种化合物,如NO、NH3、N2H4、HCN、NH4NO3等. 2CO2+N2,反应过程中部分物质的浓度变化如图所示:
2CO2+N2,反应过程中部分物质的浓度变化如图所示: